
Полная версия:
Артериальная гипертензия. Путь к здоровью сосудов и сердца
Почему так важен этот показатель – артериальное давление. Как его длительное понижение, так и повышение приводит к развитию многих патологических изменений в организме. Например, в том и другом случае нарушается доставка кислорода ко всем органам и тканям, то есть развивается хроническая тканевая гипоксия. Длительная тканевая гипоксия приводит к гиперпродукции многих биологически активных соединений (оксида азота, активных форм кислорода, цитокинов и т.д.) и возникновению каскада нарушений нормального функционирования органов и тканей. Но это тема для отдельного разговора. Главное – артериальное давление у человека должно соответствовать его биологической норме – не менее 100/60 и не более 140/90.
Какие же механизмы осуществляют контроль артериального давления? Существует точка зрения, которую разделяет большинство исследователей, что основными внутренними механизмами, участвующими в поддержании артериального давления, являются:
· центральная нервная система;
· ренин-ангиотензин-альдостероновая система.
Следует срезу отметить, что оба механизма находятся в тесной взаимосвязи. Также большое влияние на регуляцию артериального давления оказывают глюкокортикоидные гормоны, секреция которых определяется, в том числе и состоянием центральной нервной системы.
Центральная нервная система
Рассмотрим основные структуры головного мозга, через которые проходит нервный сигнал от коры головного мозга к исполнительным органам (сердцу, сосудам и т.д.). Это необходимо знать, чтобы понять, почему у такого огромного количества людей в настоящее время развивается гипертоническая болезнь.
Высший центр, оказывающий влияние практически на все вегетативные (внутренние) функции организма, – это лимбическая система, контроль которой у высших животных и человека осуществляется корой головного мозга (схема 4). В свою очередь лимбическая система имеет достаточно сложную организацию. Считается, что высшим подкорковым центром регуляции всех вегетативных функций является миндалевидное тело, входящее в ее состав и локализованное внутри височной доли, в котором «собирается информация» от коры и передается на нижерасположенные структуры мозга. Миндалевидное тело осуществляет корригирующее влияние на:
· высшую нервную деятельность – память, сенсорное восприятие, мотивационно-эмоциональную сферу;
· функциональную активность более древних структур головного мозга – экстрапирамидной системы (в том числе стриопаллидарную систему), гипоталамус, где локализуются проводящие пути и центры регуляции жизненно важных интегративных функций организма (вегетативной нервной системы, эндокринной системы).
Следующей важной структурой, к которой поступают сигналы, является гипоталамус – важнейший подкорковый интегративный центр, регулирующий соматические, вегетативные и эндокринные изменения в организме. Это сравнительно древний отдел головного мозга, поэтому у наземных млекопитающих его строение мало отличается по сравнению с организацией более поздних структур, например, коры головного мозга или лимбической системы.
Гипоталамус, с одной стороны, участвует в поддержании гомеостаза (постоянства внутренней среды) организма: терморегуляция, электролитный баланс, состояние сердечно-сосудистой системы и т. д. С другой стороны, содействует формированию типичных поведенческих реакций, обеспечивающих выживание вида: оборонительное поведение, пищевое поведение (потребление пищи и воды), половое поведение. Поведенческие реакции обеспечивают выживание каждой особи и вида в целом, что позволяет их считать причастными к поддержанию постоянства внутренней среды организма в широком смысле этого слова. Каждая реакция контролируется соматической, вегетативной и гормональной составляющими.
В гипоталамусе выделяют три зоны, в которых клетки значительно отличаются друг от друга по своим морфологическим и функциональным признакам.
В так называемой латеральной зоне располагаются нейроны:
· с помощью которых осуществляется двухсторонняя связь с верхними отделами головного мозга, в том числе с лимбической системой;
· на которые поступают сигналы по афферентным (восходящим, чувствительным) волокнам от поверхности тела и внутренних органов.
В медиальной области гипоталамуса выявлены особые нейроны, которые реагируют на изменения состояния крови (температуру, водно-электролитный состав, содержание гормонов) и спинномозговой жидкости. Они определяют изменение внутренней среды организма.
В вентромедиальной области (участок медиальной зоны) гипоталамуса находятся два типа нейронов (клеток нервной системы). В одних нейронах синтезируются и затем поступают в переднюю долю гипофиза релизинг-факторы, которые стимулируют выработку, так называемых, тропных гормонов – адренокортикотропный (АКТГ), соматотропный (СТГ), тиреотропный (ТТГ), гонадотропный и другие. В других происходит синтез гормонов – окситоцина и антидиуретического гормона (АДГ или вазопрессина), которые затем транспортируются по отросткам в заднюю долю гипофиза.
Таким образом, медиальная зона гипоталамуса является посредником между нервной и эндокринной системой.
Важно отметить, что большинство конкретных функций гипоталамуса соотнести с определенными ядрами (скоплениями клеток) невозможно, за исключением супраоптического и паравентрикулярного ядер. Также малоизучена нейронная (клеточная) организация гипоталамуса, которая играет важную роль в реализации нейрогуморальных регуляторных процессов и жизненно важных поведенческих реакций. Нейроны гипоталамуса отличаются друг от друга афферентными и эфферентными связями, высвобождающимися нейромедиаторами и расположением дендритов, что делает его важным интегративным центром.
В контексте рассматриваемой нами темы наибольший интерес представляет участие гипоталамуса в регуляции сердечно-сосудистой системы. Результаты экспериментальных исследований свидетельствуют о том, что при раздражении практически любого отдела гипоталамуса могут возникнуть реакции со стороны сердечно-сосудистой системы. Выявлено, что эти реакции в основном опосредованы симпатической нервной системы и, в меньшей степени, ветвями блуждающего нерва (парасимпатическая нервная система), иннервирующими сердце.
Наиболее древними (в эволюционном смысле) центрами являются сосудодвигательный центр (симпатическая иннервация) и ядра блуждающего нерва (парасимпатическая иннервация), которые представлены центральными нейронами вегетативной нервной системы – преганглионарными нейронами. Они регулируют гемодинамику: сердечный выброс, артериальное давление в большом круге кровообращения, распределение крови и т.д., и располагаются в головном мозге. Также эти центры называются бульбарными или ядрами солитарного тракта. Эти центры получают «информацию» по афферентным (чувствительным, центробежным) нервным волокнам от баро-, хемо- и механорецепторов предсердий и желудочков сердца, сосудов и по эфферентным нервам «посылают» сигналы к различным структурам сердечно-сосудистой системы. Чувствительные нервные волокна подходят и к высшим отделам головного мозга: миндалевидное тело, гипоталамус и т. д. Они «передают» им сигналы о состоянии внутренних органов: изменение давления в сосудах, изменение скорости кровотока, химический состав крови и т.д., и оказывают влияние на деятельность этих структур.
Итак, круг замкнулся.
Исходя их вышесказанного, становится ясно, как осуществляется регуляция артериального давления у человека.
Следует подчеркнуть еще раз, что главной (доминирующей) системой, определяющей функциональное состояние сердца и других внутренних органов, является парасимпатика (n. vagus), и только в сосудах доминирует симпатика. Таким образом, только при активации последней под влиянием внутренних или внешних факторов (стресс любого происхождения) эффекты парасимпатики отходят на второй план.
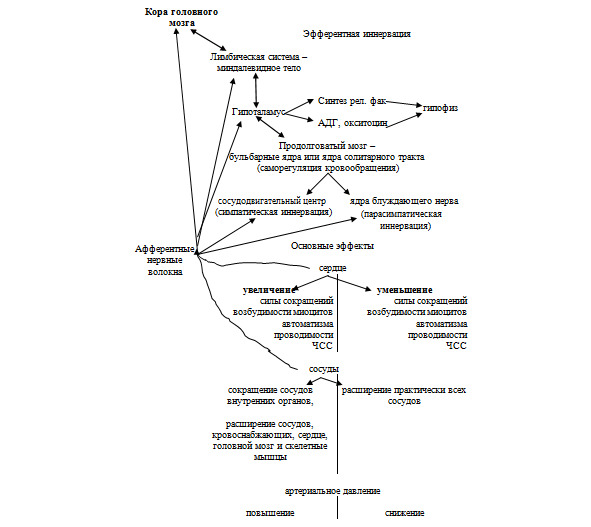
Схема 4. Роль нервной системы в регуляции функциональной активности сердечно-сосудистой системы
(Примечание: АДГ – антидиуретический гормон, рел. фак – релизинг-факторы, ЧСС – частота сердечных сокращений)
Ренин-ангиотензин-альдостероновая система
Среди наиболее изученных механизмов регуляции артериального давления вторым по значимости после центральной нервной системы является ренин-ангиотензин-альдостероновая система (РААС). Она обеспечивает восполнение объема жидкости, увеличивая общее периферическое сосудистое сопротивление (ОПСС), а также оказывает влияние на функциональную активность различных органов и тканей.
В настоящее время выделяют циркуляторное, тканевое и внутриклеточное звено РААС. Циркуляторное звено РААС исследуется уже в течение многих десятилетий, тогда как о тканевом и внутриклеточном стало известно сравнительно недавно.
Что же такое ренин-ангиотензин-альдостероновая система.
Начнем с рассмотрения циркуляторного звена РААС. Основными составляющими этого звена являются:
· ангиотензиноген,
· ренин,
· ангиотензин I,
· ангиотензин II,
· альдостерон,
· ангиотензин-превращающий фермент (АПФ).
Ренин – это фермент (вещество белковой природы, обеспечивающее протекание какой-либо реакции), который образуется в юкстагломерулярных (ЮГ) клетках почек. Поступая в кровь, он участвует в превращении ангиотензиногена (синтезируется в печени) в ангиотензин I (схема 5). Повышение высвобождения ренина происходит:
· при снижении перфузионного давления или скорости кровотока в сосудах почек – важнейший фактор регуляции высвобождения ренина;
· при стимуляции β-адренорецепторов юкстагломерулярных (ЮГ) клеток;
· при снижении растяжения приносящих клубочковых артерий;
· при уменьшении концентрации ионов натрия, хлора, кальция в крови;
· под влиянием паратиреоидного гормона и глюкагона.
Снижение высвобождения ренина наблюдается при повышении содержания ангиотензина II в сыворотке крови, а также натрийуретического фактора и соматостатина.
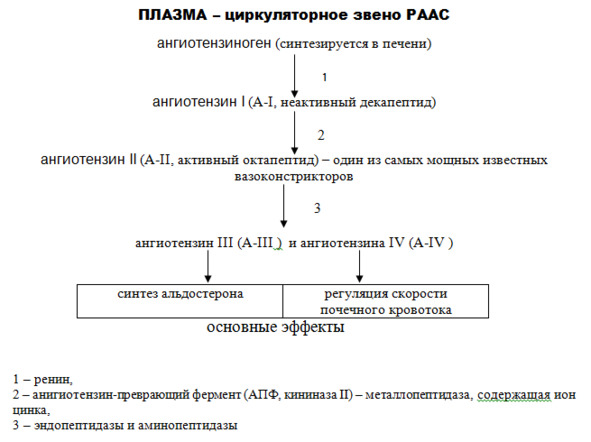
Схема 5. Основные составляющие элементы циркуляторного звена ренин-ангиотензин-альдостероновой системы
Итак, ренин необходим для синтеза ангиотензина I, который является промежуточным соединением, необходимым для синтеза ангиотензина II и других производных.
Ангиотензин II образуется при участии ангиотензин-превращающего фермента, о биологической роли которого мы расскажем ниже.
Важной составляющей циркулирующей РААС является ангиотензин II, который обладает большим спектром физиологических эффектов, опосредуемых стимуляцией специфических рецепторов. Известно 4 подтипа (разновидности) специфических ангиотензиновых рецепторов – АТ1, АТ2, АТ3 и АТ4. В наибольшей степени в настоящее время изучены рецепторы АТ1 и АТ2. На схеме 6 представлены основные места локализации и эффект стимуляции этих рецепторов.
физиологическая роль ангиотензина II

Схема 6. Локализация и основные эффекты стимуляции рецепторов ангиотензина II 1-го и 2-го типа
(Примечание: САС – симпато-адреналовая система,
на АТ1 и АТ2 – действует АТ-II, в меньшей степени – АТ-III)
Также ангиотензин II активирует:
· высвобождение молекул адгезии;
· превращение моноцитов в макрофаги, что оказывает влияние на иммунную систему;
· модификацию липопротеидов низкой плотности, что играет роль в развитии атеросклероза;
· миграцию и пролиферацию гладкомышечных клеток сосудов, то есть увеличивает формирование пенистых клеток, что оказывает влияние на изменение структуры стенки сосуда и процесс ремоделирования.
Следовательно, изменения экспрессии и/или структуры рецептора АТ1 за счет полиморфизма его гена могут приводить к изменениям в регуляции сосудистого тонуса или пролиферации элементов сосудистой стенки. Именно поэтому ген рецептора ангиотензина II типа рассматривается как один из генов-кандидатов, связанных с патологией сердечно-сосудистой системы (см. ниже).
Рецепторы третьего типа (АТ3) в основном локализованы на мембране нейронов, а функция их неизвестна. Показано, что эти рецепторы взаимодействуют только с ангиотензином II.
Рецепторы четвёртого типа (АТ4) выявлены на мембране клеток головного мозга, почек, сердца и эпителиальных тканей. В головном мозге эти рецепторы, вероятно, связаны с развитием познавательной деятельности человека, а в почках регулируют кровоток. Также предполагается участие рецепторов АТ4 в регуляции роста клеток. Взаимодействует с рецептором АТ4 только ангиотензин IV.
Как было отмечено на схеме 6, стимуляция рецепторов АТ1 приводит к увеличению синтеза и секреции альдостерона.
Альдостерон является минералкортикоидным гормоном, который синтезируется в корковом слое надпочечников, а также в различных органах и тканях, в том числе в сердце. Основными факторами, приводящими к повышению высвобождения альдостерона (кроме ангиотензина II), являются:
· гипоксия тканей – снижение количества кислорода;
· адренокортикотропный гормон – синтезируется и высвобождается из гипофиза;
· гиперкалиемия – повышенние содержание ионов калия в крови;
Также на содержание альдостерона в крови оказывают влияние такие показатели как:
· минутный объема кровотока (МОК), что может быть связано со снижением работоспособности сердца, который характеризуется величиной сердечного выброса;
· объем циркулирующей крови (ОЦК).
Уменьшение минутного объема кровотока (МОК) и объема циркулирующей крови (ОЦК) приводит к стимуляции специфических объёмных и осмотических рецепторов, локализованных в сердце и сосудах. Это вызывает повышение венозного давления (давление в венах), что в результате вызывает стимуляцию барорецепторов, расположенных в правом предсердии и полых венах. Также на фоне снижения ОЦК (уменьшение сердечного выброса) наблюдается уменьшение внутрисосудистого объёма жидкости. Это приводит к замедлению метаболизма (распада) альдостерона в печени и, соответственно, его повышению в крови.
Классическим эффектом альдостерона считается задержка натрия (а, соответственно, и воды) в обмен на повышенное выведение ионов калия и магния. Причем этот процесс наблюдается не только в почках, но и в тонком кишечнике, слюнных железах и т. д.
Помимо этого, как стало известно, сравнительно недавно, как синтезированный в надпочечниках (циркулирующий), так и в тканях (тканевой) альдостерон, стимулируя специфические рецепторы, активирует фибробласты, которые располагаются в различных органах. При этом происходит повышение синтеза коллагена.
Ангиотензин-превращающий фермент (кининаза II или АПФ) относится к классу металлопротеаз, содержащих цинк, и является бифункциональным ферментом. Этот фермент:
· катализирует образование ангиотензина II из ангиотензина I (отщепление С- концевого дипептида);
· катализирует катаболизм (распад) брадикинина с образованием неактивных пептидов.
Менее 10% АПФ находится в плазме крови, а большая его часть (более 90%) определяется как тканевой фактор в сердце и сосудах. АПФ, главным образом, локализуется в мембранах клеток эндокарда и эндотелиальных клетках.
Установлено, что у человека АПФ адвентициального (наружный слой сосуда) происхождения столь же важен в регуляции состояния сердечно-сосудистой системы, как и эндотелиальный АПФ. Нарушение экспрессии генов обоих АПФ взаимосвязано с гипертрофией левого желудочка или образованием атеросклеротических бляшек. Показано, что при использовании препаратов (периндоприл), ингибирующих как плазменный, так и тканевой АПФ (в эндотелии и адвентиции), увеличивается вероятность проявления эффекта оксида азота (NO-радикала) вследствие повышения содержания брадикинина (см. ниже).
Рассмотрев основные этапы регуляции артериального давления при участии циркуляторного звена РААС, можно прийти к выводу, что она является системой «быстрого реагирования». Эффект стимуляции данной системы в норме направлен на реализацию кратковременного контроля системного и перфузионного (в сосудах почек) давления, а также электролитного состава крови и поддержания гомеостаза внутренней среды организма. Именно с этим связаны основные эффекты стимуляции данной системы:
· положительный инотропный (сила сердечных сокращений) и хронотропный (частота сердечных сокращений) эффекты;
· задержка натрия и воды в почках;
· вазоконстрикция – сужение сосудов.
Тканевое звено ренин-ангиотензин-альдостероновой системы (РААС). В последние годы установлено, что помимо компонентов РААС, циркулирующих в крови, образование биологически активных соединений ангиотензина-II, ангиотензина (1—7) и других происходит непосредственно в тканях (почки, сердце, сосуды и т.д.). Показано, что примерно 70—80% ангиотензина II синтезируется именно в тканях из ангиотензина I или проангиотензиногена (схема 7, 1 и 2, соответственно), как внутри, так и вне клеток.

Схема 7. Тканевое звено ренин-ангиотензин-альдостероновой системы
Ангиотензин II, который синтезировался непосредственно в тканях (на наружной поверхности клеточной мембраны), участвует в хроническом воздействии на клетки и вызывает разнообразные клеточные реакции. Отмечаются две особенности:
· в результате фиксации ренина и АПФ на поверхности клеток местно создаются высокие концентрации ангиотензина II;
· образовавшийся ангиотензин II изменяет активность окружающих клеток, в которых экспрессированы рецепторы для ангиотензина II, стимулируя функциональную активность рядом расположенных клеток (паракринно), или влияет на жизнедеятельность тех клеток, на мембранах которых он образовался (аутокринно).
Внутриклеточное звено РААС. Система внутриклеточных РААС расположена в цитоплазме некоторых клеток (кардиомиоцитах, адипоцитах, клетках почек). В состав внутриклеточного звена РААС входят ферменты, субстраты и продукты реакций, а также АТ1– и АТ2-подобные рецепторы, экспрессированные на лизосомах, митохондриях и в ядрах клеток. Повышение активности системы оказывает влияние на функциональную деятельность внутриклеточных органелл (интракринная стимуляция), приводя к изменению энергетического обмена, в том числе фагоцитоза. Также активируются гены, контролирующие сократительную активность сердца, гипертрофию клеток и др. Интракринные эффекты, синтезированого в клетке ангиотензина II, связаны с изменением содержания ионов кальция (Са2+) в цитоплазме, которое повышается за счет выхода ионов Са2+ из внутриклеточных депо в цитоплазму.
Таким образом, все звенья РААС участвуют в регуляции системного и почечного кровообращения, объема циркулирующей крови и водно-солевого обмена. Тканевое и внутриклеточное звенья оказывают значительное влияние на функциональную активность различных органов и тканей непосредственно в месте их локализации.
Гормональные факторы, участвующие в регуляции артериального давления
Помимо основных систем, участвующих в регуляции артериального давления, – симпато-адреналовой и ренин-ангиотензин-альдостероновой, большое влияние на данный показатель оказывают такие гормоны как антидиуретический гормон и глюкокортикоиды – кортизон, гидрокортизон, кортикостерон.
Антидиуретический гормон (вазопрессин, АДГ) синтезируется в специфических клетках гипоталамуса (супраоптическое ядро) и поступает по нервным волокнам, образующими гипоталямогипофизарный тракт в нейрогипофизе (задняя доля), где и накапливается. В норме повышение секреции АДГ имеет адаптационно-компенсаторное значение.
Регуляция синтеза и высвобождения АДГ:
· стимуляция артериальных барорецепторов;
· повышение активности САС и РААС;
· увеличение осмолярности плазмы – повышение содержания ионов натрия в плазме крови, что может быть связано с увеличением их реабсорбции в почечных канальцах под влиянием альдостерона.
Остановимся коротко на основных эффектах АДГ:
· регулирует скорость клубочковой фильтрации в почках;
· усиливает реабсорбцию ионов натрия и воды на уровне дистальных канальцев и собирательных трубочек;
· вызывает сужение артерий (в том числе коронарных) и вен, а также повышает тонус гладких мышц сосудов за счет:
– мобилизации (высвобождения) из внутриклеточных депо (митохондрии, эндоплазматический ретикулум),
– увеличения входа в клетки ионов кальция из межклеточного пространства,
– активации протеинкиназы и кальций-кальмодулинозависимой киназы;
· приводит к развитию отрицательного хроно- (частота сердечных сокращений) и инотропного (сила сердечных сокращений) эффектов;
· уменьшает скорость поглощения кислорода клетками миокарда;
· снижает интенсивность метаболических (обменных) процессов в миокарде.
При суммировании эффектов стимуляции барорецепторов и АДГ повышается активность блуждающего нерва (парасиматическая нервная система) и снижается высвобождение медиатора (норадреналина) из окончаний периферических симпатических нервов.
Все это приводит к задержке жидкости в сосудистом русле, что сопровождается увеличением:
· объема циркулирующей крови;
· венозного возврата – скопление значительного количества крови в венах;
· общего периферического сопротивления сосудов, что развивается в результате:
– задержки ионов натрия и воды в мышечных клетках артерий,
– отёка (увеличение жидкости в межклеточном пространстве) стенок сосудов и сужения их просвета,
– ограничения расширительного резерва;
· преднагрузки, то есть нагрузки на сердце при возврате крови из вен в правое предсердие;
· сердечного выброса – повышение количества крови, которое необходимо «выбросить» сердцу из левого желудочка в большой круг кровообращения;
· сосудистой реактивности (чувствительности) к катехоламинам.
Следует подчеркнуть, что АДГ потенцирует вазоконстрикторные эффекты ангиотензина II и симпатоадреналовой системы. В свою очередь активация симпатоадреналовой системы и РААС усиливают вазоконстрикторный эффект АДГ.
Глюкокортикоидные гормоны (кортизон, гидрокортизон, кортикостерон) являются гормонами чрезвычайных обстоятельств – стресса любого происхождения. Глюкокортикоиды синтезируются в средней зоне коркового слоя надпочечников и секретируются (высвобождаются) из клеток в кровь под влиянием адренокортикотропного гормона (АКТГ) – гормона передней доли гипофиза. В свою очередь, синтез АКТГ регулируется определенным релизинг-фактором, который вырабатывается в гипоталамусе и поступает по специфическим нервным волокнам в гипофиз. Снижение содержания в крови глюкокортикоидов приводит к высвобождению АКТГ. Глюкокортикоиды оказывают определенное влияние практически на все виды обмена у человека. Рассмотрим наиболее значимые, что поможет нам понять, почему же развиваются многие изменения в организме при их гиперсекреции в течение длительного времени.
Углеводный обмен в целом активизируется, что выражается в:
· увеличении синтеза глюкозы из аминокислот (глюконеогенез);
· увеличении синтеза гликогена в печени и скелетных мышцах (повышение активности гликогенсинтетазы);
· увеличении высвобождения глюкозы из печени и относительное снижение ее поступления в клетки органов и тканей – развивается гипергликемия.
Если гипергликемия сохраняется длительное время, то повышается синтез и секреция инсулина.
Белковый обмен. Распад белков и аминокислот под влиянием глюкокортикоидов усиливается, а синтез белка угнетается. В кровь поступает большое количество продуктов распада белков (азотистых продуктов распада) и развивается отрицательный азотистый баланс. В результате замедляется регенерация (восстановление) тканей и в первую очередь структура и функция органов и тканей, в которых происходит наиболее быстрое деление клеток:
· клетки слизистой желудочно-кишечного тракта и прежде всего желудка;
· кроветворение – снижается количество в крови эозинофилов и лимфоцитов, то есть угнетается функция иммунной системы;
· нарушается заживление ран.
Жировой обмен – снижение поступления глюкозы в жировые клетки приводит к активации распада жиров (липолиза), а увеличение секреции инсулина стимулирует их синтез (липогенез). То есть на образование липидов глюкокортикоиды оказывают незначительное влияние. Однако происходит повышение содержания холестерина в крови, что увеличивает риск развития атеросклероза.



