
Полная версия:
Период полураспада группы «Хибина». Том второй
В результате ультрафильтрации из компонентов плазмы крови происходит образование первичной мочи. Содержание ионов калия в первичной моче такое же, как и в плазме крови. Движущей силой ультрафильтрации является гидростатическое давление крови в сосудах почечного клубочка (70 мм. рт. ст.). Движущей силе ультрафильтрации чинят помехи онкотическое давление плазмы крови (25 мм. рт. ст.) и гидростатическое давление ультрафильтрата в полости капсулы почки (15 мм. рт. ст.). Следовательно, движущая сила ультрафильтрации составляет 30 мм рт. столба и носит имя эффективного фильтрационного давления. На этапе ультрафильтрации энергия АТФ не расходуется. На втором этапе происходит обратное всасывание (реабсорбция) низкомолекулярных компонентов крови и калия в проксимальной части канальца почки. Существуют два пути реабсорбции: простая диффузия (по градиенту концентраций) и активный транспорт (против градиента концентраций). Так вот, активному транспорту в процессе реабсорбции требуются затраты энергии АТФ – аденозинтрифосфорной кислоты. Аденозинтрифосфат служит универсальным переносчиком энергии в клетке живого организма. Ионы натрия и калия реабсорбируются с участием биологической помпы – мембранного фермента натрий-калий зависимой АТФазы. Этот фермент имеет два полюса коммуникации: один для натрия, а другой для калия. После связывания с натрием и калием фермент АТФаза меняет свое пространственное расположение, в результате происходит активная заброска агентов калия и натрия через пограничную полосу эпителия почечных канальцев. При этом расходуется энергия гидролиза (расщепления) аденозинтрифосфата. На третьем этапе происходит процесс выделения и удаления конечных продуктов обмена и токсических соединений – секреция. Почечная секреция протекает в дистальной части канальца почки и весьма напоминает реабсорбцию. Однако секреция наблюдается в противоположном направлении – из крови капилляров в просвет канальцев. Процессы секреции и реабсорбции протекают с участием биологической помпы – мембранного фермента натрий-калий зависимой АТФазы. Кроме того в почках активно действуют процессы биосинтеза белков, необходимые другим тканям организма. В почках синтезируются отдельные компоненты свертывания крови, комплемента и фибринолиза, а также образовывается фермент ренин, который принимает активное участие в регуляции сосудистого тонуса.
К особенностям метаболизма почечной ткани следует отнести большие энергозатраты на работу биологической помпы – фермента натрий-калий зависимой АТФазы. Основной расход АТФазы обусловлен процессами активного транспорта при реабсорбции, секреции и биосинтеза белков. Ключевой путь получения АТФ, главного источника АТФазы, – это процесс окислительного фосфорилирования. Отсюда следует важный вывод: ткань почки нуждается в больших количествах кислорода. Масса почек составляет всего 0,43% от общего веса тела, а потребление кислорода почками составляет 10% от всего поступившего в организм человека кислорода. Гипоксия почек (пониженное содержание кислорода в почечной ткани) – ключевой пусковой механизм возникновения острой почечной недостаточности. При гипоксии почек нарушается почечный механизм компенсации метаболического ацидоза, который запускается значительно позже, спустя 16—18 часов от начала воздействия причинного фактора.
При метаболическом ацидозе наблюдается нарушение электролитного баланса, вызванное перемещением ионов из клетки в межклеточную жидкость и обратно. Более 90% передислокаций касаются химических элементов калия, натрия, хлора, водорода и бикарбоната. Ионы водорода и натрия перебазируются внутрь клетки, а калий выходит в межклеточную жидкость и в плазму крови. На каждые три иона калия, мигрирующего из клетки, в нее перемещаются два иона натрия и один ион водорода. Это становится причиной обострения клеточного ацидоза и нарушения работы ферментных систем, в первую очередь фермента натрий-калий зависимой АТФазы. В результате возникает гиперкалиемия с сопутствующей и прогрессирующей гипокалигистией. Гипокалигистия – это снижение содержания калия в межклеточной жидкости. Калий начинает интенсивно выводиться с мочой, повышенный уровень калия в моче может превышать нормативы в 5 раз. Процесс выделения калия с мочой может усиливаться, если в рационе питания наблюдается дефицит магния. За счет этого механизма в течение 4—7 дней при условиях наличия метаболического ацидоза содержание калия в плазме крови нормализуется. Затем наступает гипокалиемия – пониженная концентрация ионов калия в плазме крови.
Кроме того, повышенное содержание натрия в клетке (гипернатриемия) вызывает гипергидратацию клеток. Гипергидратация – это избыточное содержание воды в теле человека или отдельных его органах и частях. Внешними формами проявления гипергидратации являются отеки на лице, ногах, в полости живота, отёк легких и мозга. Такие последствия клеточной гипергидратации как отёк легких и мозга могут стать критическими признаками для жизни человека.
В почечной ткани фермент натрий-калий АТФаза потребляет 30% от общего количества синтезируемой в клетках АТФ. Следовательно, в обычных условиях среды обитания одна треть синтезируемой в клетках молекул АТФ тратится на активный транспорт ионов натрия из клетки наружу и ионов калия внутрь клетки. Так вот, аденозитрифосфорная кислота (АТФ), универсальный источник энергии для всех живых клеток, после наступления биологической смерти человека в течение 12 часов полностью распадается и исчезает.
Лимфатическая система почки. Архитектоника лимфатической системы почки находится в подчинении функциональной спецификации органа и считается второй составной частью почечной реабсорбции. Истоки паутины лимфатических капилляров нежно опутывают капсулу клубочков и канальцы. Следует отметить, что лимфатические капилляры имеют больший диаметр, чем кровеносная капиллярная сеть. Лимфатические капилляры, оплетающие клубочки и канальцы коркового вещества почки, переходят в сети, напоминающие футляр, которые обволакивают междольковые артерии и вены. Диаметр некоторых капилляров достигает больших размеров: 25—30 мкм. Сопровождая междольковые кровеносные сосуды, лимфатические капилляры становятся крупнее и впадают в лимфатические тракты калибром до 50 мкм. Крупные лимфатические сосуды снабжены клапанами и в виде футляра из вуали оплетают дуговые артерии и вены.
§2. Лаконичное досье на печень: архитектоника, физиология, биохимия и биофизика. Печень представляет собой орган, в котором белки, липиды, углеводы, минеральные вещества и витамины, всосавшиеся в пищеварительном тракте, проходят биохимическую «культивацию» и накапливаются для последующего использования другими тканями тела. Большую роль печень играет в углеводном обмене. С каждым приемом пищи организм получает углеводы, которые поступают в кровь в виде глюкозы. В том случае, когда принятое количество глюкозы превышает потребности организма, ее излишки поступают в печень и накапливаются в форме гликогена, который при необходимости распадается, превращается в глюкозу и насыщает тело биологическим топливом. Важная деталь! Природный калий принимает непосредственное участие в механизме накопления гликогена (гликогенез) и в механизме гликолиза (расщепления глюкозы) в печени. Процесс накопления гликогена влечет за собой повышенное использование калия. Мобилизация гликогена (расщепление до глюкозы), напротив, приводит к высвобождению калия и перемещению его в межклеточное пространство.
Гликоген – это полисахарид, являющийся стратегическим источником углеводов. Благодаря высоким запасам гликогена печень является углеводным депо человека. Главной причиной повышенной потребности организма в сахаре и расщепления гликогена до состояния глюкозы является дефицит энергии, например, во время высокой физической нагрузки, при голодании.
В организме «стандартного» человека находится примерно 300—400 грамм углеводной «заначки». Наибольшее количество гликогена депонируется в печени и мышечной ткани. Кроме того, в незначительных объемах гликоген имеется в клетках нервной системы, миокарда, аорты, почек и эпителия. В мышцах его содержание составляет в пределах 1—2 процентов от мышечной массы. Однако общая площадь мускулатуры человека велика и общие запасы гликогена в мышцах превышают «залежи» полисахарида в печени. Гликоген в разных органах выполняет различную функцию: в печени обеспечивает глюкозой весь организм, но в первую очередь центральную нервную систему и эритроциты, в мышцах – снабжает биотопливом двигательную активность. Следует отметить, что гликоген в гепатоцитах находится не в форме сухих гранул, а в виде желеобразного водного раствора похожего на кисель, поскольку обладает высокой способностью связывать воду. Не случайно в научном ложе гликоген получил название животный крахмал. Каждый грамм гликогена способен «стреножить» примерно 4 грамма воды. Биологический синтез гликогена происходит с поглощением ионов изотопного семейства калия. При синтезе 1 грамма гликогена поглощается 13 мг калия (Воронцов И. М.,1985).
Важная деталь! В случае, когда организм человека не получает необходимой энергии с пищей, начинается мобилизация гликогена печени. Вместе с гликогеном ткани печени покидает вода (межклеточная жидкость), в растворе которой находятся ионы природного калия. Форсированный распад углеводов с быстрой утилизацией запасов гликогена наблюдается во время терминального периода (предагония, агония, клиническая смерть) любого происхождения. Для травматического шока характерным признаком является форсированный выброс гликогена из печени. При травме, сопровождаемой потерей крови, отмечается полное исчезновение гликогена через 30—60 минут шокового состояния.
В 1944 году главный патологоанатом Красной Армии Н. А. Краевский при исследовании печени трупов лиц, умерших в результате травматического шока, обнаружил своеобразные изменения гепатоцитов, выражающиеся в резком просветлении цитоплазмы клеток. Указанные изменения цитоплазмы гепатоцитов Краевский объяснял исчезновением гликогена из клеток печени. В судебно-медицинской практике отсутствие гликогена в печени встречается довольно часто, в том числе в случаях смерти не связанных с травматическим шоком. При насильственной смерти от различных механических воздействий отсутствие гликогена в гепатоцитах наблюдается в большей степени выраженности. При этом смерть пострадавших наступала при незначительном по продолжительности терминальном периоде: предагональное состояние, агония, клиническая смерть.
Научными экспериментами доказано, что гликоген является весьма неустойчивым веществом. Отличительная его особенность – быстрая утилизация из депо при продолжительном терминальном периоде, шоковых состояниях, а также после наступления биологической смерти. Посмертный период характеризуется исчезновением гликогена из печени, в результате чего при вскрытии трупа в срок более 24 часов после смерти человека исследование биосубстратов на гликоген дает отрицательный результат.
В организме человека природного калия больше всего в мышечной ткани, сердце, головном мозге, почках и печени. В клетках печени ионы калия преимущественно связаны с гликогеном. По оценкам различных авторов количество гликогена в печени здорового человека может варьировать в пределах 5—10 процентов от массы органа. Следовательно, в печени «стандартного» человека запасы гликогена составляют 85—170 грамм, среднее значение – 127,5 грамм. При синтезе 1 грамма гликогена поглощается 13 мг калия. Итого в гликогене печени «стандартного» человека содержится примерно 1657 мг калия, что составляет 47% от всего количества калия, находящегося в печени.
Кровоток печени. Кровоснабжение печени осуществляется через воротную вену и печеночную артерию. Воротная вена собирает кровь от всего желудочно-кишечного тракта, селезенки и поджелудочной железы. Кровь, поступающая в печень через воротную вену, насыщена белками, липидами, углеводами, минеральными веществами и витаминами, которые являются основой синтеза в процессе пищеварения. Объем крови, который поступает через воротную вену в печень, достигает 70% циркулирующей крови в органе, и лишь 30% крови поступает через печеночную артерию. Кровь, доставляемая этой артерией, насыщена кислородом. Особенность кровоснабжения печеночной ткани заключается в том, что клетки печени питаются венозной и артериальной кровью. В кровеносных капиллярах печени (синусоиды) циркулирует смешанная кровь. Уникальность кровотока позволяет за короткий промежуток времени прогнать сквозь печень всю венозную и артериальную кровь.
Клетки печени получают огромное количество крови: через 100 грамм печени циркулирует 85 мг крови в одну минуту. При этом в органе наблюдается замедленный кровоток, что благоприятствует наиболее полному обмену между кровью и клетками печени. Замедление кровотока объясняется наличием в печени колоссальной сети капилляров с площадью поперечного сечения примерно 400 квадратных метров. Кроме того, в кровеносных сосудах печени, особенно в печеночных венах, имеются сфинктеры, которые регулируют ток крови в зависимости от состава химических веществ, содержащихся в крови, циркулирующей через печень.
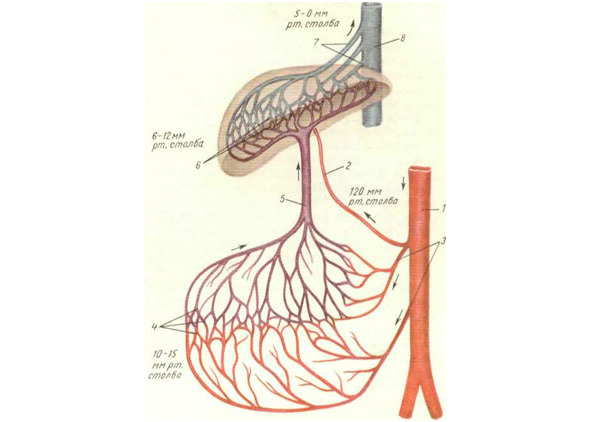
Рис. №3. Схема кровотока портального русла и разность кровяного давления.
Условные обозначения к рис. №3: 1 – аорта; 2 – печеночная артерии; 3 – брыжеечные артерии; 4 – первая сеть капилляров портального русла; 5 – воротная вена; 6 – вторая (внутрипеченочная) сеть капилляров портального русла; 7 – печеночные вены; 8 – нижняя полая вена (по В. В. Парину и Ф. З. Меерсону).
Гемодинамика печеночного кровоснабжения через воротную вену представляет довольно таки простую систему, обеспечивающую постепенное падение высокого кровяного давления в брыжеечных артериях до минимальных показателей в печеночных венах. Кровь брыжеечных артерий под прессингом 120 мм рт. столба поступает в капиллярную сеть кишечника, желудка, поджелудочной железы. Кровяное давление в капиллярной сети составляет, как правило, 10—15 мм рт. столба. Из этой капиллярной паутины кровь продвигается в венулы и вены, образующие воротную вену, в ней давление крови в нормальных условиях не превышает 5—10 мм рт. столба. Из воротной вены движение крови осуществляется по направлению в междольковые капилляры, оттуда кровь поступает в систему печеночных вен и перемещается в нижнюю полую вену. Кровяное давление в печеночных венах находится на минимальном уровне 5—0 мм рт. столба (рис. №3).
Таким образом, разница давления между устьем и истоком портального русла, обеспечивающая поступательный кровоток в печени, составляет 90—100 мм рт. столба. Всего через портальное русло у «стандартного» человека протекает в среднем 1,5 литра крови в минуту, что составляет примерно 30% минутного общего объема крови в живом организме. Печеночные вены вместе с системой воротной вены являются огромным резервуаром крови, имеющим ключевое значение в гемодинамике, как в обычных условиях, так и при патологии. В сосудах печени может сконцентрироваться одновременно более 20% общего объема крови. Следует отметить, что печень, как и мозг, потребляет 20% кислорода, который поглощает организм человека из воздуха.
Значение портального резервуара крови в нормальных условиях состоит в том, что депо обеспечивает своевременную доставку необходимого объема крови к интенсивно функционирующим органам и тканям. Например, при высоких физических нагрузках наблюдается быстрое высвобождение большого количества крови печени, усиливающего кровоток к миокарду и работающим мышцам тела. При больших кровопотерях, например, в случае получения тяжелой травмы в автомобильной аварии, на фоне уменьшенного притока крови к печени, происходит активная депортация крови из печеночного депо в общий кровоток. В возникновении этого механизма, как при высокой физической нагрузке, так и при массивной кровопотери важную роль играет активация симпатического департамента нервной системы и концентрация гормона адреналина в крови. Читателям напоминаю, что лыжный поход туристов группы «Хибина» по уровню физических нагрузок относился к высшей категории трудности.
В условиях патологии способность портального русла депонировать кровь может достигать критических объемов. Это проявляется, в частности, при тяжелых формах шокового состояния, когда сосуды брюшной полости переполняются кровью. В результате чего в портальном русле может скапливаться 70% всей крови организма. Такая ситуация, как правило, становится причиной резкой анемии сердца и мозга.
Ключевая особенность кровоснабжения печени – высокая проницаемость капиллярной сети, что очень важно для обеспечения процессов обмена между клетками печени и кровью. Высокая проницаемость капиллярной архитектоники печени обусловлена отличительной чертой строения капилляров. Стенка капилляров печени напоминает собой тонкую пористую пленку с расположенными на ней звездчатыми клетками. Капиллярная паутина печени относится к особому типу капиллярной сети с большими открытыми порами (30—40 мкм) в пограничной мембране. В научной литературе такие сети известны как прерывистые капилляры, дислоцируются в печени и селезенке, где наблюдается повышенная биологическая миграция жидкостей, электролитов и продуктов обмена.
При стрессовых ситуациях (например, лыжный поход высшей категории трудности) и патологии (например, травматический шок) в результате нарушения механизмов энергоснабжения клетки и повреждения клеточных мембран происходит дисбаланс ионов и водной среды. Калий выходит из клетки и насыщает межклеточное водное пространство, откуда через механизмы транскапиллярного обмена проникает в сосудистое русло: кровь, лимфа. Важная деталь! Калий, покинувший клетку в условиях дефицита энергии, в других органах и тканях человека утилизации не подвергается и практически сразу выводится через почки в мочу.
Выделительная функция печени заключается в секреции желчи. Продукт секреции образуется в печени непрерывно, а в тонкий кишечник поступает только в процессе пищеварения. Вне пищеварения желчь собирается в желчный пузырь, в котором концентрация ее компонентов изменяется за счет обратного всасывания воды. Желчь на 90% состоит из воды, минеральных солей, слизи, липидов холестерола, лецитина, желчных кислот и билирубина. Клетки печени образуют тонкие пластинки, подобные кирпичной кладке, которые разделяются узкими щелевидными пространствами – пространство Диссе. Субэндотелиальное пространство Диссе представляют собой синусоиды (неравномерно расширенные сосуды) заполненные кровью. По строению синусоиды эквивалентны пористой капиллярной сети. В стенках синусоидов есть поры, позволяющие проникать таким крупным молекулам как альбумин и липопротеин. По мельчайшим канальцам – желчным капиллярам, локализованным пограничными мембранами двух соседних клеток печени, – желчь стекает в более крупные канальцы Геринга. Канальцы внутри долек печени и между ними сливаются и образуют в конечном итоге печеночный проток, от последнего отходит пузырный проток к желчному пузырю. После слияния печеночный и пузырный протоки формируют общий желчный проток, который открывается в двенадцатиперстную кишку.
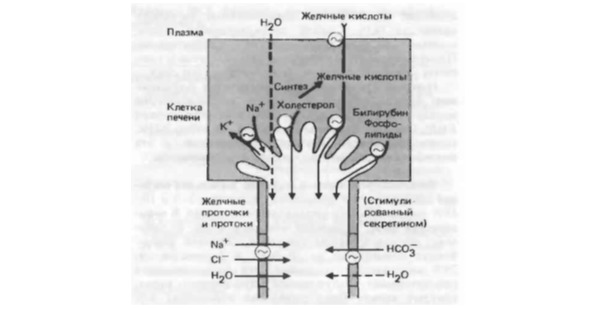
Рис. №4. Механизмы секреции желчи.
В сутки по канальцам и протокам печени выделяется около 600 мл желчи со скоростью 0,4 мл в минуту. Концентрация электролитов в печеночной желчи такая же, как в плазме крови, за исключением бикарбонатов, которых в желчи в два раза больше. Емкость желчного пузыря составляет всего 50—75 мл. Половина секретируемой в печени желчи перед поступлением в тонкий кишечник проходит через желчный пузырь. Разница между количеством желчи, поступающей в желчный пузырь, и его емкостью компенсируется высокоэффективной реабсорбцией воды в желчном пузыре. В течение нескольких часов из желчи всасывается обратно до 90% воды. Движущей силой реабсорбции является активный транспорт ионов натрия при участии биологической помпы – натрий-калий зависимой АТФазы. Вслед за ионами натрия перемещаются ионы хлора и бикарбонаты. В межклеточном пространстве эпителия желчного пузыря создается высокая концентрация ионов натрия, в результате возникает осмотический градиент, способствующий к накачиванию воды, которая впоследствии оттекает в капилляры. Так вот, в составе желчи выделяемой печенью и в пузырной желчи содержится примерно 275 мг природного калия. Удельный вес калия за счет печеночной желчи составляет 5% от общего содержания калия в печени.
Лимфатическая система печени. Лимфа – это жидкий компонент внутренней среды человека, образующийся из тканевой жидкости. Лимфа примерно на 96% состоит из воды, в которой в растворенном состоянии присутствуют продукты обмена, белки (альбумины, глобулины), лейкоциты, липиды, глюкоза и минеральные вещества. Лейкоциты подразделяются на два вида: зернистые (нейтрофилы, эозинофилы, базофилы) и незернистые (лимфоциты и моноциты). В лимфоидной жидкости лейкоциты представлены в большей степени лимфоцитами, эритроцитов и тромбоцитов практически нет.
Количество лимфотока в теле человека составляет примерно 2 литра в сутки, однако концентрация лимфы в органах различная и зависит от их функции. Больше всего лимфы в органах, где наблюдается высокая проницаемость кровеносных сосудов: печень, селезенка, скелетные мышцы, сердечная ткань. На 1 кг массы печени содержится от 20 до 40 мл лимфы, что на несколько порядков больше, чем в сердце. Лимфатическая система печени состоит из поверхностных и глубоких сосудов. Поверхностные сосуды окутывают орган снаружи в виде тончайшей вуали. Глубокие лимфатические сосуды, отделяясь от поверхностной сети, пронизывают ткань печени, в синусоиды частично проникают капилляры. Лимфатическая сеть «сопровождает» кровеносные сосуды, желчные протоки и, выходя через ворота печени, направляется в грудной лимфатический проток.
Высокая проницаемость синусоидных капилляров пространства Диссе в печени способствует образованию большого количества лимфы. Установлено, что 50% общего количества лимфы, которая образуется в организме человека в состоянии покоя, формируется в печени. Высокое содержание лимфы в печени можно объяснить ее сопричастностью в перемещении питательных веществ из кишечника. Состав электролитов в лимфе, как правило, мало чем отличается от такового в межтканевой жидкости. Следовательно, содержание калия в лимфе печени здорового человека незначительное.
Важная деталь! Лимфатические капилляры по своему строению имеют закрытое (слепое) начало, в результате чего движение лимфы осуществляется только в одном направлении, которое называется оттоком. Стенка лимфатического капилляра состоит из одного слоя клеток эндотелия, между клетками есть пространства в виде щелей, размеры «окон» могут варьировать и достигать диаметра до 75 мкм. Эти тонкости строения лимфатических капилляров способствуют проницаемости ионов в широких пределах в пассивном состоянии.
§3. Лаконичное досье на таурин. В 2001 году в сборнике научных трудов ФГУП «Тихоокеанский научно-исследовательский рыбохозяйственный центр» редакция журнала поместила интересную статью Н.Б.Аюшина «Таурин – фармацевтические свойства и перспективы получения из морских организмов». Спустя четыре года в первом номере журнала Гродненского государственного медицинского университета была опубликована потрясающая статья «Биосинтез и обмен таурина». Авторы творческого шедевра доктора медицинских наук В.М.Шейбак и Л.Н.Шейбак раскрывают роль таурина в метаболизме человека. Так что же представляет органическое соединение в номинации «бык» обнаруженное в составе бычьей желчи немецкими учеными физиологом Тидеманом и химиком Гмелиным в 1827 году?
Таурин – это особая серосодержащая бета-аминокислота (NH2—CH2—CH2-SO3H), которая синтезируется в организме человека из аминокислоты цистеин преимущественно в мозге и печени. Катализатором биосинтеза является витамин пиридоксин, при условии его достаточного количества. Следовательно, недостаточность витамина В6, которая имеет место в результате неадекватного питания, уже через несколько дней может снижать возможность синтеза таурина в организме. Каждые сутки в организме образуется от 50 до 125 мг таурина. Ключевые факторы, требующие дополнительных «поставок» цистеина – высокие физические нагрузки, стрессы и патологические состояния. Несмотря на эндогенное производство таурина, сохраняется необходимость его поступления с пищей. В продуктах питания таурина больше всего содержится в тканях морских организмов: мидиях, крабах, креветках, моллюсках, морском зайце, трепанге, белой рыбе, мясе птицы, а также в небольших количествах в куриных яйцах, молоке и твороге. Растительные продукты таурина не имеют. В теле «стандартного» человека содержится примерно 70 грамм таурина преимущественно в свободном виде. Суточная потребность здорового человека составляет 100 – 400 мг.



