 Полная версия
Полная версияПолная версия:
Согласованные рекомендации Американского фонда кистозного фиброза (муковисцидоза) и Европейского общества кистозного фиброза по лечению микобактериоза у пациентов с кистозным фиброзом
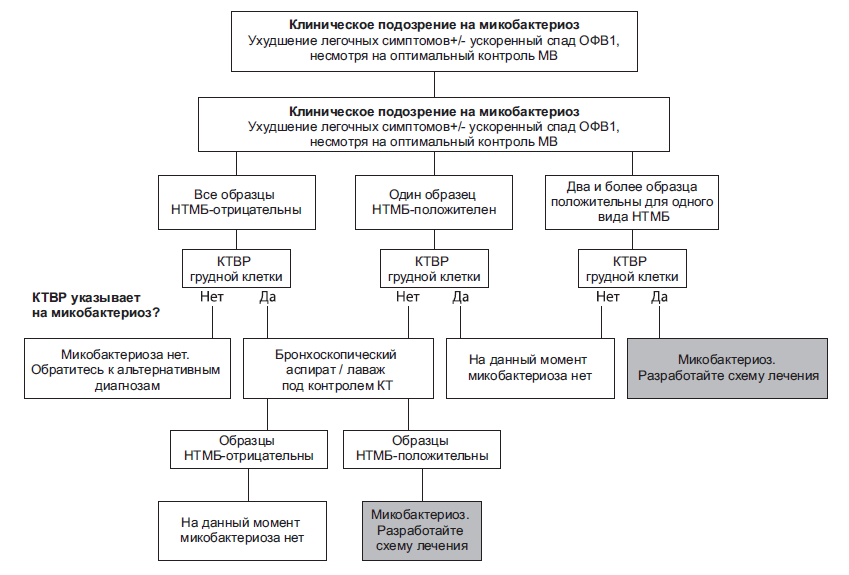
Рисунок 1. Предлагаемый алгоритм обследования пациентов с клиническим подозрением на микобактериоз (кислотоустойчивые микобактерии – КУБ; муковисцидоз/кистозный фиброз – МВ; объем форсированного выдоха в секунду – ОФВ1; КТ высокого разрешения – КТВР)
Из 107 пациентов с микобактериозами, вызванными М. abscessus, проходивших лечение в Национальном еврейском центре Денвера, штат Колорадо, 69 пациентов без MB проходили лечение и наблюдались в среднем 34 месяцев129. Для пациентов были составлены индивидуальные режимы лечения, в соответствии с рекомендациями ATS/IDSA. У двадцати пациентов (29 %) сохранялись высевы культур, у 16 (23 %) наблюдалось положительные изменения с последующим рецидивом, у 33 пациентов (48 %) конверсия на отрицательные культуры не сопровождалась рецидивом, в то время как 17 пациентов (16 %) умерли в период исследования. Для гораздо большего числа хирургических пациентов, по сравнению с терапевтическими пациентами, конверсия на отрицательные результаты высевов стабильно сохранялась в течение минимум 1 года (57 % в сравнении с 28 %, р=0,022).
Как и в предыдущем исследовании пациентов из Южной Кореи, положительный эффект могло дать оперативное лечение. Тем не менее, хирургическое лечение менее применимо к пациентам с MB, для которых нетипично очаговое легочное поражение легких.
В исследовании с отдаленным результатом Koh и другие91 сообщали о важных различиях в результатах проводимой терапии в зависимости от подвида, который служил причиной инфекции М. abscessus ассоциированного микобактериоза. Показатели ответа на стандартную комбинированную терапию были гораздо выше у пациентов с M.a.massiliense, чем у пациентов с М.а. abscessus. Изменение выделения культуры НТМБ из мокроты наблюдалось у 88 % пациентов с M.a.massiliense, по сравнению с 25 % пациентов, инфицированных М.a.abscessus с (р<0,001). Все культуры M.a.abscessus имели функциональный ген erm полной длины41, который в итоге давал индуцибельную резистентность к макролиду при инкубировании штаммов с кларитромицином. Напротив, минимальная доза ингибитора для штаммов M.a.massiliense не возрастала после инкубации с макролидами, т.к. ген erm41 содержал делецию, приводящую к нарушению его функции. Новейшие данные той же группы исследователей показали, что кларитромицин является гораздо более сильным индуцирующим фактором гена erm41, чем азитромицин, и это позволяет предположить, что второй макролид более вероятно является препаратом выбора при лечении инфекций, вызванных М. a. abscessus98.
Несмотря на клиническую значимость легочной инфекции, вызванной М. abscessus у пациентов с MB, данные по результатам лечения чрезвычайно ограничены. Имеется один эпизодический отчет, сообщающий о эрадикации М. abscessus у пациента с MB, который проходил длительный курс попеременной месячной терапии с ингаляциями амикацина и пероральным приемом кларитромицина137. Однако практика показывает, что такой исход лечения мало распространен. Недавнее исследование серии случаев 52 пациентов, включая 15 пациентов с MB, с инфекциями, вызванными М. abscessus и/или M. chelonae, позволяет предположить, что режим лечения на основании тигециклина может быть предпочтительным, т.к. у 10 из 15 пациентов с MB были выявлены явные улучшения138.
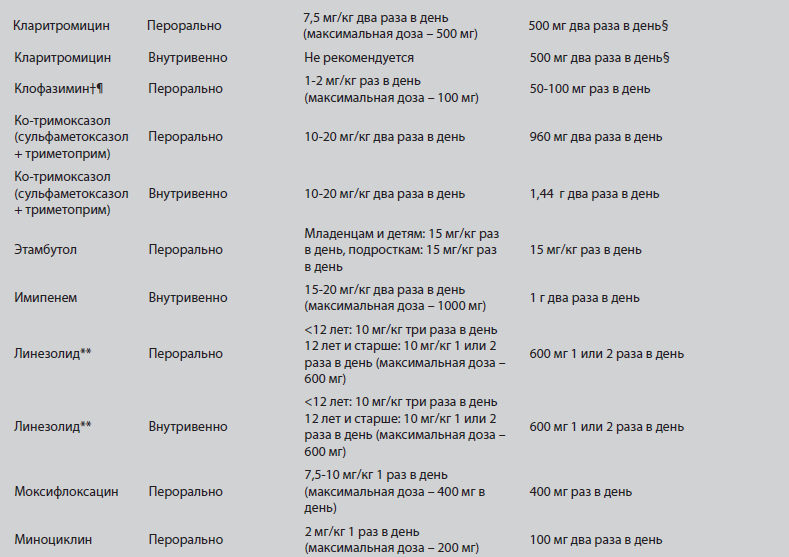
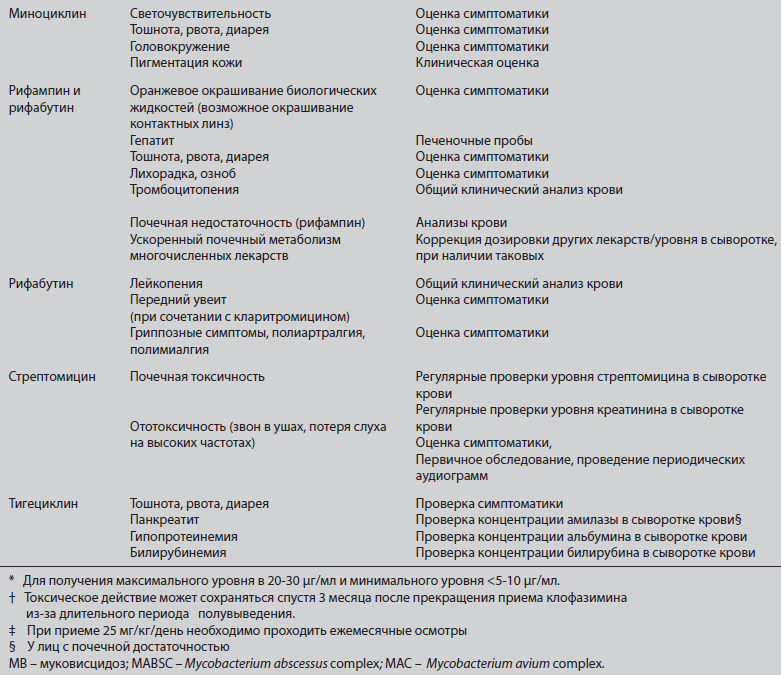
Рекомендуемая клиническая практика для антибиотикотерапии микоабктериоза, вызванного М. abscessus при MBТипичная схема лечения пациентов с MB и инфекцией, вызванной М. abscessus приведена на Рисунке 2. Режимы приема антибиотиков представлены в Таблице 2, а значимые побочные эффекты/явления токсичности описаны в Таблице 3.

Рисунок 2. Типичные схемы лечения пациентов с MB и микобактериозом, вызванным М. abscessus или представителями MAC. (A) Лечение инфекции, вызванной М. abscessus подразделяется на первоначальный интенсивный этап перорального лечения макролидом (предпочтительно азитромицином) и внутривенного лечения амикацином, с дополнительным назначением одного и более антибиотиков внутривенно (тигециклин, имипенем, цефокситин) в течение 3-12 недель (в зависимости от тяжести инфекции, ответа на лечение и переносимости лекарственного режима); на этапе продолжения назначаются макролид перорально (предпочтительно азитромицин), а также ингаляции амикацина и 2–3 дополнительных антибиотиков (миноциклин, клофазимин, моксифлоксацин, линезолид). При выборе антибиотиков следует ориентироваться на тест на лекарственную чувствительность, но не руководствоваться им. Важным представляется базовое и промежуточное исследование на токсичность препарата (В). Лечение инфекций, вызванной MAC (для штаммов, чувствительных к кларитромицину) должно включать ежедневный пероральный прием макролида (предпочтительно азитромицина), рифампицин и этамбутол. Изначальный курс инъекций амикацина или стрептомицина следует рассматривать при наличии (i) положительных образцов мазка на КУБ из дыхательных путей, (ii) рентгенологических признаков полостей в легких или тяжелой инфекции, а также (iii) системных признаков заболевания. Важным представляется базовое и промежуточное исследование на токсичность (КУБ – кислотоустойчивые бактерии; MB – муковисцидоз; КТВР – компьютерная томография высокого разрешения; MAC – комплекс Mycobacterium avium).
Учитывая недостаток данных клинических испытаний для ознакомления с принятыми решениями по лечению, наблюдается существенное разнообразие назначаемых режимов терапии. Первоначальный интенсивный этап стандартно используется для быстрого снижения бактериальной нагрузки. Сочетание внутривенного введения двух препаратов с установленной in vitro активностью назначается на срок от нескольких недель до нескольких месяцев в сочетании с пероральным приемом одного или нескольких препаратов. Схема внутривенного введения амикацина с цефокситином и/или имипенемом и/или тигециклином является наиболее распространенной. К препаратам с установленной in vitro активностью относятся макролиды (кларитромицин и азитромицин), линезолид, клофазимин, а также периодически: ципрофлоксацин и/или моксифлоксацин. По окончании интенсивного этапа лечения пациентам обычно назначают, по меньшей мере, два препарата перорально в дополнение к макролиду, с ингаляцией антибиотиков или без нее.
Однако возникает все больше опасений по поводу того, что лечению пациентов с инфекцией, вызванной М. abscessus, у которых имеется либо ген erm41 (что фенотипически выражается в индуцибельной резистентности к макролиду), либо мутация 23 S rRNA (что приводит к высокой конститутивной резистентности к макролиду) может препятствовать переход с внутривенной на пероральную терапию (учитывая относительно низкую эффективность перорального приема антибиотиков), и, в таком случае, может быть показана продолжительная/сверхпродолжительная внутривенная терапия двумя и более эффективными антибиотиками.
Выбор внутривенных препаратов основан на активности in vitro и профиле токсичности препарата. Наряду с амикацином, имипенем является одним из препаратов выбора в качестве сопутствующей внутривенной терапии; препарат имеет высокую активность in vitro, в то время как профиль побочных эффектов благоприятнее, чем у цефокситина и тигециклина. В исследовании, о котором сообщают Jeon с соавторами136, 60 % пациентов, начинавших лечение цефокситином, были вынуждены прервать курс из-за токсичности препарата, после, в среднем, 22 дней лечения. Нейтропения наблюдалась у 51 %, тромбоцитопения – у 6 % пациентов, принимавших цефокситин. Тигециклин имеет низкую минимальную подавляющую дозу в отношении М. abscessus и проявил свою эффективность в отношении М. abscessus в сочетании с другими антибиотиками138. Тем не менее, прием тигециклина нередко вызывал тошноту и рвоту, в результате чего длительный прием препарата проблематичен138.
Несколько перорально назначаемых препаратов проявляют значительную активность in vitro в отношении М. abscessus; из них только макролиды проявляют постоянную активность, хотя их применение может быть потенциально ограничено индуцибельной резистентностью (как описано выше) или приобретением точечных мутаций в гене 23 S рРНК. Клинических испытаний по сравнению азитромицина и кларитромицина при инфекции, вызванной М. abscessus не проводилось, поэтому выбор макролида стандартно основывается на активности in vitro, профиле побочных эффектов и учете взаимодействий препаратов. Активность in vitro кларитромицина несколько выше, чем у азитромицина, однако данные по влиянию каждого из этих препаратов на экспрессию гена erm41 противоречивы98,139,140. Кларитромицин является более мощным ингибитором ферментной системы Р450, чем азитромицин, поэтому побочные взаимодействия препаратов с ним более распространены.
Линезолид демонстрирует активность in vitro приблизительно у 50 % культур М. abscessus (хотя и со значительными географическими вариациями); тем не менее, часты случаи гематологической (анемия, тромбоцитопения) и неврологической токсичности (периферическая нейропатия, ретробульбарный неврит), в особенности при дозировке линезолида 600 мг два раза в день в течение длительного времени. По этой причине многие лечащие врачи назначают 600 мг один раз в день для снижения риска неблагоприятных эффектов. Тем не менее, необходимо действовать с особой осторожностью при лечении пациентов с хроническими сопутствующими инфекциями метициллин-резистентного золотистого стафилококка (MRSA), т. к. длительная терапия линезолидом может спровоцировать резистентность MRSA. Фторхинолоны и миноциклин/доксициклин редко демонстрируют активность in vitro, хотя они и включены в стандартную схему лечения, приведенную в отчете Jeon и других98. Наконец, клофазимин обладает значительной активностью in vitro в отношении М. abscessus141. Однако данный препарат, применяемый для лечения проказы, на данный момент, не представлен в свободном доступе в США, хотя его можно получить по протоколу, одобренному Международным реестром биологической безопасности (IRB), с подачей заявления об исследовании нового препарата для индивидуальных нужд пациентов в Федеральную службу США по надзору в сфере здравоохранения (FDA). Инструкции по данной процедуре представлены на сайте компании NTM Info and Research, Inc., (http://www.ntminfo.org/clofazimine).


Недостаток пероральных антибиотиков с активным действием в отношении М. abscessus привел к тому, что лечащие врачи применяют ингаляции амикацина, обычно на этапе продолжения лечения. Исследования по соотношению результатов лечения пациентов с инфекцией, вызванной М. abscessus и дозы ингаляции амикацина отсутствуют, следовательно, наблюдается разнообразие в использованных дозах (250–500 мг) и частоте введения (один или два раза в день). Недавнее исследование по изучению пациентов с рефрактерными инфекциями, вызванными НТМБ, у большинства из которых не наблюдался MB, но выделялись М. abscessus, оценивало воздействие дополнительных ингаляций амикацинана на схемы перорального и/или внутривенного лечения другими препаратами142. Из 20 пациентов со стабильным выделением культур НТМБ, 8 (40 %) продемонстрировали по меньшей мере один положительный высев, а у 5 (25 %) наблюдались стабильно отрицательные высевы после введения в схему лечения ингаляций амикацином. У семи пациентов (35 %) ингаляции амикацином были приостановлены из-за токсичности. На данный момент имеется значительный интерес к потенциальному использованию липосомальной формы амикацина (которая может обеспечить улучшенную фармакокинетику препарата в легочной ткани и макрофаги) в рамках комбинированного режима терапии как для инфекций, вызванных М. abscessus, так и вызванных MAC. Продолжаются крупные многоцентровые исследования.
Оптимальная продолжительность терапии неизвестна. На основании исследований пациентов без MB даже режимы длительного лечения были связаны с высокими показателями неблагоприятного исхода лечения и рецидива. Многим пациентам, у которых не произошла эрадикация НТМБ, продолжение или повтор курсов лечения может принести пользу.
Лечение микобактериозов, вызванных mac (mycobacterium avium complex)
Какие схемы применения антибиотиков необходимо использовать пациентам с MB, с микобактериозом, вызванным бактериями MAC, согласно критериям Американского торакального сообщества/Американского сообщества по инфекционным болезням?
Рекомендация 29: Американский фонд MB (CFF) и Европейское общество MB (ECFS) рекомендуют одну и ту же схему лекарственной терапии для всех видов НТМБ, относящихся к группе MAC.
Рекомендация 30: Американский фонд MB (CFF) и Европейское общество MB (ECFS) рекомендуют в случае с чувствительной к кларитромицину формой микобактериоза, вызванного НТМБ группы MAC применять лекарственную схему лечения на основе ежедневного перорального приема макролида (предпочтительно азитромицина), рифампина и этамбутола.
Рекомендация 31: Американский фонд MB (CFF) и Европейское общество MB (ECFS) не рекомендуют применять прерывистую схему (три раза в неделю) перорального приема антибиотиков для лечения микобактериоза, вызванного НТМБ из группы MAC.
Рекомендация 32: Американский фонд MB (CFF) и Европейское общество MB (ECFS) категорически не рекомендуют применение монотерапии макролидным препаратом или иным антимикробным средством при лечении микобактериоза, вызванного НТМБ из группы MAC.
Рекомендация 33: Американский фонд MB (CFF) и Европейское общество MB (ECFS) рекомендуют при лечении микобактериозов, вызванных НМТБ из группы MAC проводить начальный курс амикацина внутривенно при наличии одного или нескольких нижеследующих условий: i. Положительный мазок на наличие кислотоустойчивых бактерий (КУБ) в материале из дыхательных путей; ii. Рентгенологическая картина образования в легких каверн или тяжелой инфекции; iii. Системные признаки заболевания.
Рекомендация 34: Американский фонд MB (CFF) и Европейское общество MB (ECFS) считают, что лечением пациентов с формой микобактериозов. вызванных НТМБ из группы MAC, резистентной к кларитромицину, должны совместно заниматься специалисты в области микобактериозов и MB.
Существует очень мало опубликованных данных результатов рандомизированных контролируемых клинических исследований с оценкой лечения заболеваний легких, вызванных MAC у пациентов с отрицательным диагнозом ВИЧ, а также отсутствуют какие-либо публикации исследований у пациентов с MB. В эпоху отсутствия макролидов в Великобритании провели рандомизированное клиническое исследование пациентов без MB с каверзным туберкулезом легких, согласно которому у пациентов, которые принимали рифампин и этамбутол, показатели частоты неэффективности/рецидивов составили 41 % по сравнению с 16 % у пациентов, которые принимали рифампин, этамбутол и изониазид (р=0.033)143. В последующем исследовании с такой же группой испытуемых у пациентов, которые рандомизированно получали рифампин, этамбутол и кларитромицин, общая смертность составила 48 % по сравнению с 30 % у пациентов, которые рандомизированно принимали рифампин, этамбутол и ципрофлоксацин144.
Тем не менее, только 13 % пациентов, которые принимали кларитромицин, показали неудовлетворительные результаты или вторично заболели по сравнению с 23 % пациентов из группы, которые принимали ципрофлоксацин.
В дополнение к этому, проводился ряд не сравнительных исследований для оценки эффективности лечения заболеваний легких, вызванных MAC у пациентов с отрицательным диагнозом ВИЧ. Основная часть пациентов принимала внутрь 3 лекарственных средства, включая макролиды (кларитромицин или азитромицин), рифамицин (рифампин или рифабутин) и этамбутол, в сочетании с изначальным курсом аминогликозида (стрептомицин, амикацин или канамицин)124, 125, 145148. Конверсия культуры существенно менялась во время исследований (13–82 %), но в целом у 55–65 % пациентов, конверсия культуры проходила спустя 6-12 месяцев после лечения, и, согласно отчетам, среднее время от начала лечения до конверсии культуры составило 3–5 месяцев124,125. Неэффективность лечения была связана с предыдущим лечением заболеваний легких, вызванных MAC, кавернозным туберкулезом легких, другими формами туберкулезом легких, невосприимчивостью к кларитромицину на начальном этапе лечения, непереносимостью лечения микобактериоза, приобретенной устойчивостью к кларитромицину124,125,145,147149.
В исследовании с 30 пациентами применялось альтернативное лечение с использованием клофазимина с макролидом и этамбутолом, по результатам которого конверсия культуры составила 87 %, а уровень эффективности лечения – 67 %150.


Хотя 5 (19 %) пациентов заболели вторично спустя 17 месяцев после завершения лечения, все изоляты MAC остались восприимчивыми к кларитромицину, увеличивая вероятность повторной инфекции, но не свидетельствуя о полной неэффективности лечения151. В других исследованиях при применении клофазимина в сочетании с кларитромицином и миноциклином, конверсия культуры составила 64 % у пациентов, до конца участвовавших в исследовании (47 % от общего числа), что может указывать на важность этамбутола в комплексной терапии для лечения заболеваний легких, вызванных MAC152.
Устойчивость к кларитромицину выработалась у штаммов MAC, выделенных от 15 % пациентов, проходивших лечение при заболеваниях легких, и это было в общем связано с использованием в лечении только кларитромицина, или отклонений от терапии дополняющими препаратами124,126,146,149. При приеме в сочетании с этамбутолом и рифамицином, приобретенная устойчивость к кларитромицину выработалась у штаммов MAC, выделенных только от 12/303 (4 %) пациентов. При устойчивости к кларитромицину лучшие результаты лечения продемонстрировали пациенты, у которых была проведена хирургическая резекция и которые получали более 6 месяцев внутривенные инъекции аминогликозида (амикацина или стрептомицина)124"126, поскольку 11/14 (79 %) из пациентов, получивших такое лечение, достигли конверсии культуры по сравнению с 1/27 (4 %) пациентов, у которых не проводилась хирургическая резекция и которые не принимали внутривенные инъекции аминогликозидов123.
Интермиттирующий и ежедневный режим дозирования являются одинаково эффективными в некоторых случаях у пациентов без MB, интермиттирующий режим характеризуется меньшей токсичностью, лучшей переносимостью и лучшей комплаентностью, а также меньшей стоимостью147,148. Тем не менее, более крупное многофокусное исследование с применением интермиттирующего режима дозирования у пациентов с заболеваниями легких средней или тяжелой степени, вызванными MAC (включая кавернозный туберкулез легких, и предыдущую неэффективность лечения), показало конверсию культуры только 13 % спустя 12 месяцев после лечения146,151. На сегодняшний день не существует исследований пациентов с MB для определения оптимального режима дозировки для лечения заболеваний легких, вызванных MAC, однако обеспокоенность вопросами фармакокинетики и фармакодинамики препарата и его проникновения в легкие у пациентов с MB определило тот факт, что многие центры приняли протоколы ежедневного режима дозирования.
Преимущества использования аминогликозида во время первоначальной стадии лечения антибиотиками микобактериозов, вызванных MAC, не установлены. В многоцентровом исследовании с участием 146 пациентов с отрицательным диагнозом ВИЧ, с заболеваниями легких, вызванными MAC, участники выборочно получали внутримышечные инъекции стрептомицина (15 мг/кг) или плацебо три раза в неделю первые 3 месяца лечения, в дополнение к кларитромицину, рифампину и этамбутолу У пациентов, которые принимали стрептомицин, был отмечен более высокий уровень конверсии культуры спустя 2 года после лечения по сравнению с пациентами, которые получали плацебо (71 % против 51 %, р<0.05), но у трети пациентов из каждой группы было выявлено повторное появление мокроты, а также никаких значительных изменений в симптомах или результатах рентгенограмм у групп отмечено не было153. Более того, никакой статистически значимой разницы в уровнях конверсии культур между пациентами, которые получали внутримышечные инъекции канамицина (78 %) и теми, кто не получал их (58 %) в нерандомизированном исследовании пациентов с заболеваниями легких, вызванными MAC, не было выявлено125.Недавно был опубликован отчет об использовании амикацина в аэрозоли в дополнение к стандартному комплексному лечению с применением макролидов для пациентов с отрицательным диагнозом ВИЧ с заболеваниями легких, вызванными MAC.Стандартное лечение оказалось неэффективным для этих пациентов154. У четырех пациентов было выявлено отсутствие роста культуры спустя 6 месяцев после лечения, у одного пациента была обнаружена бактерия M.chelonae (устойчивая к амикацину), у 2 пациентов вновь было выявлено выделение MAC, и 1 пациент не смог длительное время переносить аэрозольное лечение амикацином. Согласно недавнему отчету у 20 пациентов без MB с непереносимостью терапиимикобактериозов (5 из которых имели заболевания легких, вызванные MAC), которые принимали амикацин через ингалятор (250 мг 1 или 2 раза в день)142, были выявлены побочные эффекты в 35 % случаев. Лечение у двух пациентов было прекращено из-за потери слуха. Сейчас ведутся исследования по применении липосомального амикацина (имеющего меньше побочных эффектов) для лечения микобактериозов у больных MB.
Рекомендованное клинической практикой антибактериальное лечение поражения легких у больных MB с микобактериозом, вызванным MACТипичная схема лечения для пациентов с MB с микобактероизом, вызванным MAC, показана на рисунке 2. В таблице 2 представлена схема приема антибиотиков с важными побочными/токсическими действиями, описанными в таблице 3.
Пациенты с заболеваниями легких, вызванными штаммами MAC, восприимчивыми к кларитромицину, должны принимать ежедневно внутрь комбинации антибиотиков, которые включают макролид, рифампин, этамбутол (15 мг/кг), в соответствии с рекомендациями ATS/IDSA26. Интермиттирующая терапия с приемом внутрь антибиотиков не рекомендована в связи с природой сопутствующего заболевания легких и вопросами абсорбции антибиотиков при MB. Поскольку прямых сравнительных исследований между результатами лечения пациентов с заболеваниями легких, вызванными MAC, кларитромицином и лечением азитромицином не существует, для лечения MB следует выбрать азитромицин, поскольку его можно применять один раз в день, его уровень в сыворотке менее зависим от рифамицинов122, и его положительное действие на пациентов с MB и микобактериозами доказано.
Пациенты с высокой бактериальной нагрузкой (согласно положительному результату в тесте микроскопии мазка мокроты, наличию каверны и/или существенных воспалительных процессов в легких, или систематических симптомов на рентгенограммах) могут почувствовать улучшения после первоначального (1–3 месяца) курса внутривенных инъекций амикацина или стрептомицина в дополнение к стандартному курсу лечения из трех препаратов для пациентов с заболеваниями легких, вызванными MAC. Имеющиеся данные не показывают различий между токсичностью при приеме 15 мг/кг амикацина 1 раз в день или 25 мг/кг три раза в неделю, ото-токсичность была выявлена у 37 % всех участников (была связана со старшим возрастом и большими суммарными дозами), вестибулярная токсичность была обнаружена в 8 % (обычно обратимая токсичность), почечная токсичность в 15 % (обычно мягкая и обратимая)155. Применение амикацина в виде аэрозоля вместо внутривенного аминогликозида может быть более предпочтительным ввиду менее тщательного наблюдения и меньшего токсического действия, однако данные результатов лечения остаются неполными, и эффективность такого лечения для пациентов с кавернами легких, с субтерапевтическими уровнями концентраций препаратов сомнительна.



