 Полная версия
Полная версияПолная версия:
Муковисцидоз: определение, диагностические критерии, терапия. Национальный консенсус
10. В общих помещениях держаться от других больных на расстоянии не менее 1 метра. Категория B 11. Использовать лицевую маску. Категория С
12. Диагностические службы (кабинет рентген-диагностики, УЗИ и др.) должны быть осведомлены о правилах изоляции больных МВ. Категория С
13. Правила поведения в стационаре должны быть выданы родителям и ребенку при госпитализации.
4.4.6. Профилактика инфекций вне лечебных учреждений
Больные МВ в одной семье
1. Не использовать общие предметы (зубные щетки, посуда, дыхательное и кинезитерапевтическое оборудование). Категория А
2. Проводить кинезитерапию в разных комнатах и в разное время, не использовать дыхательные тренажеры друг друга. Категория А
3. Больные МВ, не живущие в одной семье, должны соблюдать меры предосторожности: не здороваться за руку, избегать тесных контактов, держаться друг от друг на расстоянии 1 м. Категория B
4. Обработка небулайзера (очистка, дезинфекция) после каждого использования. Категория А
Организация спортивных лагерей, летних школ, совместного отдыха и мероприятий, проведение праздников для больных МВ недопустимы!Школы, ДДУ и другие образовательные учреждения
1. В одной школе могут учиться несколько больных МВ, но они не должны обучаться в одном классе. Категория А
2. Больные МВ не должны находиться в одном помещении (столовая, физкультурный зал) одновременно. Категория В
3. Если они находятся в одном помещении, должны держаться на расстоянии не менее 1 м друг от друга и соблюдать все меры профилактики. Категория В
4. Учителя и медицинские работники должны быть информированы о правилах поведения детей в школе.
Школы для родителей и другие мероприятия, посвященные МВ
Больные МВ должны избегать контакта. Необходимо разрабатывать образовательные программы по МВ, не требующие прямого контакта между больными: видеозаписи, видеоконференции, образовательные порталы в Интернете.
Строительство, ремонт, садоводческие работы
Больные МВ должны избегать мест, где проводятся строительство, ремонт и садоводческие работы, чтобы избежать контакта со спорами Aspergillus spp.
Источники инфицирования
Водные источники инфицирования
1. Вода из-под крана. Может содержать атипичные микобактерии, синегнойную палочку, грибы. Вода, очищенная с помощью фильтров, не пропускающих частицы > 0,2 мкм, безопасна, но тем не менее использовать ее как питьевую можно только после кипячения. Для разведения ингаляционных растворов использовать стерильную воду. Стерильная вода может со временем контаминироваться, как быстро это происходит, неизвестно [3, 4, 5].
2. Аспираторы, небулайзеры (возможна передача инфекции от оборудования больному). Для аэрозольной терапии используются только стерильные растворы, применять их следует с соблюдением асептики. После каждого использования необходимо проводить дезобработку и стерилизацию оборудования.
3. Душевые кабины в бассейне, аквапарки, бассейны малого объема (в том числе детские бассейны при отелях) могут стать источником инфекции.
4. Водоемы со стоячей или загрязненной водой, родники (небольшие озера и водохранилища, особенно с большим количеством диких птиц и др.).
Профилактика водного пути инфицирования
1. Полоскать рот и употреблять в пищу только кипяченую или бутилированную воду. Категория С
2. Использовать для ингаляционной терапии только стерильные растворы. Категория А
3. Смывать воду в унитазе только при закрытой крышке. Категория С
4. Обрабатывать небулайзер после каждого использования. Категория А
5. Менять фильтры и стакан небулайзера 1 раз в 6 месяцев и при проведении эрадикационной терапии инфекций. Категория С
6. Дезинфицировать назальный душ после каждого использования. Категория А
7. У детей раннего возраста для анализа микробной флоры проводить глубокий мазок из зева или получать мокроту, используя индивидуальный аспиратор. Категория С
8. Не мыться в душевой кабине до и после посещения бассейна. Категория С
9. Избегать купания в мелких бассейнах, аквапарках, загрязненных водоемах. Категория С
10. Не употреблять воду из источников и родников. Категория С
Пищевой путь инфицирования
1. Недостаточно промытые овощи/фрукты/ягоды
2. Некачественная термическая обработка продуктов
3. Использование в пищу несвежих овощей/фруктов/ягод
4. Грибы A. fumigatus могут содержаться в кукурузе, орехах, семенах и зерне
Профилактика пищевого пути инфицирования
1. Использовать для обработки овощей, ягод и фруктов специальные дезинфицирующие средства.
Категория С
2. Адекватная термическая обработка мясных и морепродуктов. Категория С
3. Не использовать в пищу подгнившие или заплесневелые овощи, ягоды, фрукты. Категория С
Литература
1. Diagnostic accuracy of oropharyngeal cultures in infants and young children with cystic fibrosis.
Rosenfeld M., Emerson J., Accurso F., Armstrong D., Castile R., Grimwood K., Hiatt P., McCoy K., McNamara S., Ramsey B., Wagener J. Pediatr. Pulmonol. 1999 Nov; 28(5):321-8.
2. Sputum induction in young cystic fibrosis patients K. De Boeck, M. Alifier, S. Vandeputte Eur Respir J. 2000; 16: 91-94.
3. Guidelines for prevention of nosocomial pneumonia. Resp. Care. 1994;39:1191-1236.
4. Favero M.S., Carson L.A., Bond W.W., Petersen N.J. Pseudomonas aeruginosa: growth in distilled water from hospitals. Science. 1971;173:836-8
5. Carson L.A., Favero M.S., Bond W.W., Petersen N.J. Morfological, biochemical, and growth characteristics of pseudomonas cepacia from distilled water. Appl Microbiol. 1973; 25: 476-83.
6. Постановление Главного государственного санитарного врача РФ от 09.12.2010 г. № 163 «Об утверждении СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами» (вместе с СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические правила и нормативы…») (зарегистрировано в Минюсте РФ 17.02.2011 г., № 19871), http://www.consultant.ru/document/cons_doc_LAW_110948/
5. Терапия муковисцидоза
5.1. Ингаляционная терапия
Ингаляционная терапия при муковисцидозе
При МВ важно соблюдать последовательность этапов ингаляционной терапии, которую часто проводят в комплексе с кинезитерапией [1, 5]: на первом этапе – ингаляции с бронхолитиками при необходимости с целью максимально увеличить просвет бронхов для адекватной вентиляции легких и удаления мокроты из бронхиального дерева; на втором – ингаляции с муколитиками (они могут выполняться сразу после ингаляций бронхолитиков) для разжижения мокроты и более легкой эвакуации ее во время занятия; на третьем – кинезитерапия (комплекс дыхательных упражнений) с максимальным удалением мокроты из дыхательных путей; на четвертом – ингаляции с антибиотиком через компрессионный ингалятор или в форме порошка через специальное устройство (по показаниям); на пятом этапе возможна ингаляция глюкокортикоидов (по показаниям).
Бронходилатационная терапия
Хроническое воспаление неизбежно ведет к повреждению бронхолегочных структур. В ответ на воспаление стенки бронхов утолщаются, в них увеличивается число гладкомышечных клеток, причем в большей степени это выражено в периферических дыхательных путях [6]. Респираторная аллергия у больных МВ встречается в 48–60% случаев [6], а бронхиальная астма – у 1/3 больных [7].
Бронходилататоры у детей с МВ следует применять только по потребности. Ингаляционные β2-агонисты быстрого действия являются препаратами выбора для купирования бронхоспазма при обострении астмы, обструктивном бронхите. Частая потребность в них (более 3–4 р/сут) является признаком недостаточного контроля над заболеванием и диктует необходимость исключения бронхиальной астмы. Использовать β2-агонисты быстрого действия (сальбутамол, фенотерол) лучше через спейсер большого объема (у детей раннего возраста используется лицевая маска). При тяжелом приступе, остром бронхоспазме и в первые годы жизни предпочтение отдают небулайзерной терапии. Используют растворы β2-агонистов быстрого действия – сальбутамола, фенотерола, комбинированные препараты – β2-адреномиметики в сочетании с М-холиноблокаторами, которые позволяют усилить бронхорасширяющее действие и существенно уменьшить суммарную дозу β2-адреномиметиков (ипратропия бромид и фенотерола гидробромид; ипратропия бромид и сальбутамола сульфат) [8]. Препараты применяют для ингаляций в возрастных дозировках, добавляя 1,5–2,0 мл физиологического раствора натрия хлорида (NaCl 0,9%). Эффективность антихолинергических препаратов ипратропия бромида при МВ не доказана. Действие при МВ тиотропия бромида – преимущественного блокатора М3-холинорецепторов – продолжает изучаться, но доказательная база по нему также отсутствует.
При сохраняющихся эпизодах затрудненного дыхания (одышки, удушья) в течение суток и пробуждениях в ночные и предутренние часы предпочтение отдают комбинированным препаратам, которые предназначены для длительного лечения заболевания, а не для купирования приступов [9]. Согласно предложению FDA (Food and Drug Administration, 2013), детям и подросткам, которые нуждаются в добавлении β2-агонистов длительного действия к терапии ингаляционными глюкокортикоидами, следует назначать только препараты с фиксированной комбинацией, содержащие и ингаляционный глюкокортикоид, и β2-агонист длительного действия, для обеспечения комплаентности с применением обоих препаратов (аэрозольные дозированные или порошковые ингаляторы), например, беклометазон/формотерол, будесонид/формотерол, флутиказон/формотерол, флутиказон/салметерол и мометазон/формотерол) [9, 10, 11]. Рациональность таких комбинаций связана с комплементарностью действия компонентов. Глюкокортикоиды снижают десенситизацию и толерантность β2-рецепторов, повышают интенсивность их синтеза в слизистой оболочке дыхательных путей. Пролонгированные β2-агонисты стимулируют неактивный глюкокортикоидный рецептор, в результате чего он становится более чувствительным к стероид-зависимой активации [12–14].
У детей раннего возраста используют комбинацию флутиказона и салметерола. У детей старше 12 лет может применяться комбинация будесонида и пролонгированного бронхолитика формотерола [9, 15, 16].
Ингаляционные глюкокортикоиды
При тяжелой бронхиальной обструкции и бронхиальной астме на фоне МВ препаратами базисной терапии являются ингаляционные глюкокортикоиды. Их дозы зависят от возраста и тяжести течения заболевания; препараты могут использоваться длительно (Global Initiative For Asthma, GINA, www.ginasthma.com) [9]. Назначают такие препараты, как беклометазон, флутиказона пропионат, будесонид, флунизолид. Если симптомы обострения не купируются, доза гормона временно может быть удвоена. Побочное действие ингаляционных глюкокортикоидов по сравнению с пероральными минимально, оно может проявляться при длительном использовании в дозах более 1000–1500 мкг/сут [4, 15, 16].
Суспензия будесонида для небулайзерной терапии у детей – один из наиболее изученных препаратов [13, 14, 15]. В настоящее время опубликованы результаты более 15-ти рандомизированных контролируемых клинических исследований эффективности и безопасности данного препарата у детей в возрасте от 3 мес до 18 лет при бронхиальной обструкции разной степени тяжести [13, 15, 17].
Муколитическая терапия
Повышение вязкости бронхиального секрета в респираторной системе играет ключевую роль в формировании хронического бронхолегочного воспалительного процесса у больных МВ. Большая часть изменений в легких может быть результатом воспаления, развивающегося вторично вследствие высвобождения нейтрофилами в дыхательных путях протеолитических ферментов. Жидкость, полученная при бронхоальвеолярном лаваже, содержит большое число нейтрофилов и повышенную концентрацию свободной нейтрофильной эластазы, ДНК и интерлейкина-8 уже в раннем возрасте [1, 4, 7]. Препараты, обладающие муколитическим действием, разжижают секрет верхних и нижних дыхательных путей и тем самым снижают его вязкость. Целью муколитической терапии является нормализация вязкоэластических свойств секрета и оптимизация мукоцилиарного транспорта, который обеспечивает эвакуацию секрета из легких и придаточных пазух носа. Общим правилом муколитической терапии являются достаточная гидратация больного и обязательное проведение кинезитерапии. Проведение муколитической терапии должно контролироваться врачом, особенно у детей младшего возраста, больных со сниженным кашлевым рефлексом и нарушениями экспекторации другого генеза – во избежание ухудшения функции внешнего дыхания. Одновременное применение препаратов, подавляющих кашель, противопоказано [1, 2].
Дорназа альфа (Пульмозим) – препарат для ингаляций – является очищенным раствором рекомбинантной человеческой дезоксирибонуклеазы. Механизм его действия заключается в расщеплении молекул внеклеточной ДНК, которые накапливаются в бронхиальном секрете вследствие распада нейтрофилов, макрофагов и бактериальных клеток и повышают его вязкость. Применение дорназы альфа снижает вязкость секрета верхних и нижних дыхательных путей, и ее назначают всем больным со смешанной и респираторной формой МВ независимо от показаний функции внешнего дыхания и возраста, в т.ч. пациентам без клинических проявлений болезни. Следует применять с осторожностью у тяжелых больных (ФЖЕЛ менее 40% от нормы) [1, 4, 18]. Одна доза препарата содержит 2,5 мг дорназы альфа, что соответствует содержимому 1 ампулы (2,5 мл неразведенного раствора, т.е. 2500 ЕД); принимается 1 р/сут. У некоторых больных при тяжелом течении лучшего эффекта лечения можно добиться при применении суточной дозы препарата 2 р/сут. Сообщается о возможности эндобронхиального введения препарата [18, 19]. Дорназу альфа также можно вводить при помощи джет-небулайзера/компрессора многоразового пользования, возможно применение меш-ингаляторов [20]. Дорназа альфа – фермент, который быстро разрушается и теряет свои свойства при нарушении инструкции по медицинскому применению. Важно помнить, что препарат представляет собой водный раствор без буферных свойств и не должен разводиться или смешиваться с другими препаратами или растворами в емкости небулайзера [4, 5, 18].
В многочисленных контролируемых исследованиях подчеркивается, что применение дорназы альфа улучшает функцию легких у больных МВ как в краткосрочных, так и в длительных наблюдениях [21].
В некоторых исследованиях отмечено снижение частоты обострений и улучшение вентиляции легких [22, 23]. Длительное применение препарата ассоциировано со снижением скорости уменьшения ОФВ1 [24]. Сообщается об успешном лечении синуситов у больных муковисцидозом с дорназой альфа с использованием ингалятора Pari sinus [25]. Следует подчеркнуть, что для препарата наряду с муколитическими также характерны противовоспалительные и антибактериальные свойства, которые обеспечиваются за счет снижения концентрации эластазы и интерлейкина-8 в мокроте, уменьшения процентного содержания нейтрофилов, снижения концентрации нейтрофильной эластазы и интерлейкина-8 в жидкости бронхоальвеолярного лаважа, влияния на биопленки мукоидной синегнойной палочки, снижения содержания матричных металлопротеиназ в жидкости бронхоальвеолярного лаважа, т.е. уменьшения вклада деструктивного компонента легочной ткани при воспалении [22, 23]. Исходя из анализа данных 12 740 пациентов регистра США (1996–2008 гг.), 2538 случаев смерти пациентов в течение 6 лет наблюдений, был сделан вывод, что ингаляции с дорназой альфа сокращают смертность на 15% [26].
Развития существенных нежелательных явлений при лечении дорназой альфа не отмечено. Возможно появление фарингита, ларингита, ринореи, бронхоспазма и гипертермии. Обычно побочные эффекты имеют преходящий характер и редко требуют отмены терапии [1]. При крупномасштабном эпидемиологическом исследовании пациентов, включенных в регистр больных МВ и получавших лечение дорназой альфа, установлено, что потенциально серьезные нежелательные явления имели место у 26 (0,38%) больных из 6829, причем дети младшего возраста (младше 5 лет) переносили ингаляции с дорназой альфа так же хорошо, как и более старшие [21].
Таким образом, дорназа альфа – муколитический препарат, который действует на все три звена «порочного круга» МВ – обструкцию, инфекцию и воспаление. Препарат следует считать базовым муколитиком и назначать всем больным МВ сразу после постановки диагноза [1, 5, 24].
Муколитики других групп
Гипертонический раствор NaCl
В настоящее время при МВ используют также ингаляции 3–7% раствора NaCl. Повышение концентрации соли в бронхиальном секрете приводит к его активному увлажнению и улучшению функции мукоцилиарного транспорта [30]. Систематический обзор, посвященный этому вопросу, показывает, что, по данным краткосрочных исследований, ингаляционное введение гипертонического раствора приводит к улучшению мукоцилиарного транспорта и функции легких у больных МВ по сравнению с контрольной группой [30, 31]. При таком подходе к лечению отмечается не только положительная динамика функции внешнего дыхания у пациентов, но и высокая вариабельность результатов и значительная (до 30%) частота развития нежелательных явлений в виде кашля и бронхоспазма. При появлении побочных эффектов рекомендуется применять бронходилататоры и снижать концентрацию раствора до 3-5% [1, 4]. В целом исследователи относят раствор к группе со значительной востребованностью и уровнем доказательности В (Раздел 11 «Уровень убедительности доказательств…»).
Для улучшения комплаенса при использовании гипертонического раствора в оптимальной терапевтической концентрации – 7% – исследовались в том числе различные добавки, в частности гиалуроновая кислота (ГК) – полисахарид, присутствующий в тканях человека. Гиалуроновая кислота, компонент внеклеточного матрикса, является высокомолекулярным гликозаминогликаном, который состоит из повторяющихся дисахаридов N-ацетилглюкозамина и глюкуроновой кислоты. Интересные исследования по применению ГК были проведены не только при муковисцидозе, но и при астме, и при эмфиземе легких [43, 44, 45]. Учеными было показано, что ГК блокирует возникновение бронхоспазма, вызываемого нейтрофильной эластазой [46], а также что ГК, регулируя баланс жидкости в интерстиции легких, облегчает вентиляцию и газообмен. Кроме того, вдыхание 7% гипертонического раствора, в который был добавлен 0,1% раствор гиалуроната натрия, оказалось значительно приятнее по вкусу, чем без гиалуроната натрия [47, 48]. Наличие 0,1% гиалуроната натрия обеспечивает защиту слизистой оболочки дыхательных путей от раздражающего действия гипертонического раствора. Благодаря хорошей переносимости лечение может быть максимально длительным и комфортным. В Российской Федерации 7% гипертонический раствор в сочетании с 0,1% гиалуроната натрия зарегистрирован в 2015 г. (Гианеб, производство «Кьези Фармацевтичи С.п.А.», Италия). Ингалировать по одному флакону (5 мл) два раза в день или соответственно предписанию врача. Лечение можно начать с меньшего количества препарата и увеличивать дозу постепенно. Продолжаются клинические исследования в терапевтической и педиатрической практике наблюдательного характера.
Сухой порошок маннитола для ингаляций обладает осмотическим действием и задерживает жидкость в секрете, покрывающем слизистую оболочку бронхов. В небольшом числе исследований сообщается, что препарат улучшает функцию легких у некоторых больных МВ и применяется в том случае, если у больных не отмечается значимого эффекта от лечения дорназой альфа и они плохо переносят гипертонический раствор. Перед применением маннитола рекомендуется предварительное использование бронходилататоров из-за риска развития бронхоспазма [1, 4, 32]. Клинические наблюдения, проведенные в последнее время, продемонстрировали клиническую эффективность и безопасность препарата (В – уровень доказательности), и в настоящее время препарат Бронхитол («Фармаксис Лтд.», Австралия) зарегистрирован в Российской Федерации. Рекомендуемая дозировка препарата Бронхитол-Фармаксис составляет 400 мг (10 капсул 40 мг с помощью ингалятора) 2 раза в день. Дозы должны приниматься утром и вечером за 2-3 часа до сна. За 5-15 минут до приема препарата Бронхитол-Фармаксис пациент должен получить бронхолитический препарат.
N-ацетилцистеин применяют в клинической практике для снижения вязкости бронхиального и назального секретов. Действие ацетилцистеина связано со способностью его сульфгидрильных групп разрывать дисульфидные связи кислых мукополисахаридов мокроты, что приводит к деполяризации мукопротеидов и уменьшению вязкости слизи.
Фармакокинетика препарата зависит от пути введения. При ингаляционном введении он способствует снижению вязкости секрета, при приеме внутрь эффект может быть незначительным из-за низкой биодоступности препарата. Несмотря на длительную практику применения ацетилцистеина, существуют предположения о его недостаточной эффективности, особенно при длительном применении, поскольку действие ацетилцистеина приводит к выборочной деполимеризации муцина и не затрагивает структуры ДНК и F-актина [1, 27, 28]. Однако в последние годы применение препарата в качестве муколитического средства ограничено ввиду высокого риска развития нежелательных явлений и не рекомендуется за рубежом в качестве ингаляционной терапии при МВ [29].
Амброксол активирует движение ресничек эпителия, восстанавливает мукоцилиарный транспорт, стимулирует образование бронхиального секрета пониженной вязкости за счет изменения структуры мукополисахаридов. Стимулирует продукцию сурфактанта, повышая интенсивность его синтеза, секреции и затормаживая его распад, что препятствует проникновению в клетки эпителия патогенных микроорганизмов. У Амброксола имеются противовоспалительные и антиоксидантные свойства. Следует учитывать, что заметный клинический эффект при пероральном применении Амброксола наблюдается не ранее чем через 4–6 сут применения [33]. У больных МВ препарат используют как муколитическое средство и в качестве стимулятора синтеза сурфактанта [1, 2]. Контролируемых исследований эффективности Амброксола у больных МВ не опубликовано, в связи с чем он не рекомендован за рубежом при МВ [29].
Соответствие использования ингаляционной терапии при муковисцидозе критериям доказательной медицины
В многочисленных исследованиях было показано, что наибольший муколитический эффект отмечается при лечении дорназой альфа (А). В последние годы также была продемонстрирована высокая достоверность эффективности и безопасности использования маннитола и гипертонического раствора натрия хлорида (В). Зафиксирован бронхолитический эффект применения β-адреномиметиков на фоне обструкции при МВ (В). Для других муколитиков рекомендации с высоким уровнем доказательности отсутствуют [29].
Способы ингаляционной терапии
В настоящее время обсуждается возможность совместного введения препаратов при проведении ингаляций, что сократит время процедуры и увеличит комплаентность больных [34, 36]. Идея крайне заманчивая, однако использовать в клинической практике эти рекомендации рано, т.к. исследований in vivo по большинству препаратов не проводилось.
При назначении ингаляционных препаратов следует уделять внимание выбору средств доставки аэрозоля и технике проведения ингаляций, при этом необходимо учитывать вероятные побочные эффекты при применении тех или иных устройств (Табл. 1).
Таблица 1. Вероятные побочные эффекты при проведении ингаляционной терапии
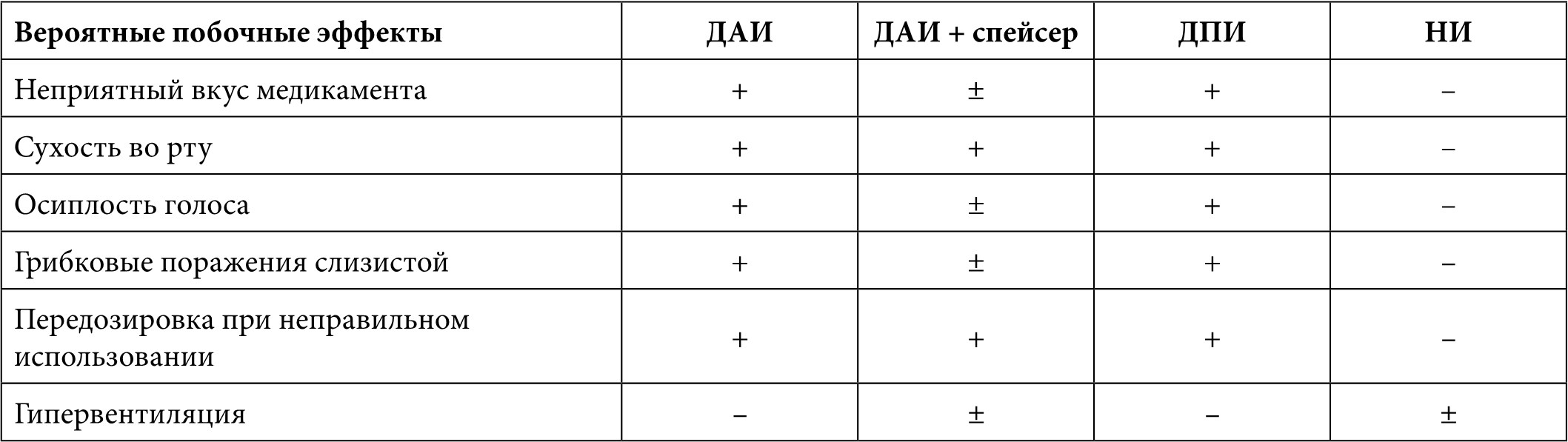
Примечание. ДАИ – дозированный аэрозольный ингалятор, ДПИ – дозированный порошковый ингалятор, НИ – небулайзерный ингалятор
Наиболее распространены дозированные аэрозольные ингаляторы, дозированные порошковые ингаляторы и небулайзеры. В зависимости от возраста пациента могут быть использованы различные способы ингаляционной терапии, улучшающие доставку препарата в легкие. Проблема синхронизации вдоха с моментом поступления лекарственного препарата – одна из самых важных при использовании дозированных аэрозольных ингаляторов. Не все дети бывают в состоянии правильно освоить этот дыхательный маневр, поэтому для оптимизации осаждения медикамента применяют распределяющее устройство – спейсер [35].
Спейсер – это специальная камера, которая служит промежуточным резервуаром для аэрозоля лекарства и облегчает применение ингаляторов. При этом лекарство из баллончика ингалятора сначала поступает в спейсер, а затем уже вдыхается пациентом. Спейсер может использоваться с маской или мундштуком.



