 Полная версия
Полная версияПолная версия:
Муковисцидоз: определение, диагностические критерии, терапия. Национальный консенсус
2. Ветряной оспы – для лиц, не болевших ветряной оспой. При экстренной вакцинации вводится вакцина Варилрикс (GlaxoSmithKline Biologicals, s.a. (Бельгия)) или Окавакс (Sanofi Pasteur, Франция) однократно. Целесообразно ее вводить в течение первых 72-96 часов после контакта. У пациентов, принимающих кортикостероиды, количество лимфоцитов перед вакцинацией должно быть более 1200/мм3 крови.
3. Менингококковой инфекции.
4. Полиомиелита.
Пациентам, которые готовятся к трансплантации, необходимо сделать прививку против ветряной оспы, пневмококковой инфекции и гриппа за месяц до проведения трансплантации [8].
Заключение. Таким образом, дети с муковисцидозом в РФ должны вакцинироваться с помощью 12 вакцин и ежегодно против гриппа. По эпидемиологическим показаниям они могут быть привиты от гепатита А, менингококковой инфекции, ветряной оспы.
Взрослых следует прививать по Национальному календарю от четырех инфекций (дифтерии и столбняка, кори, краснухи, против гепатита В), по эпидемиологическим показаниям проводят вакцинацию против гепатита А, ветряной оспы, менингококковой инфекции, полиомиелита.
Схема вакцинации против синегнойной инфекции и РС-инфекции разрабатывается для всех возрастов. Данных, соответствующих требованиям доказательной медицины по безопасности и эффективности вакцинации при муковисцидозе, нет, и, вероятно, их появление будет в ближайшее время затруднено в связи с недостаточной доказательностью их применения в общей популяции и активного применения в ежедневной практике. Доказательства, полученные при вакцинации детей и взрослых без муковисцидоза, свидетельствуют об их целесообразности и одобрены согласительными документами европейских и американских экспертов.
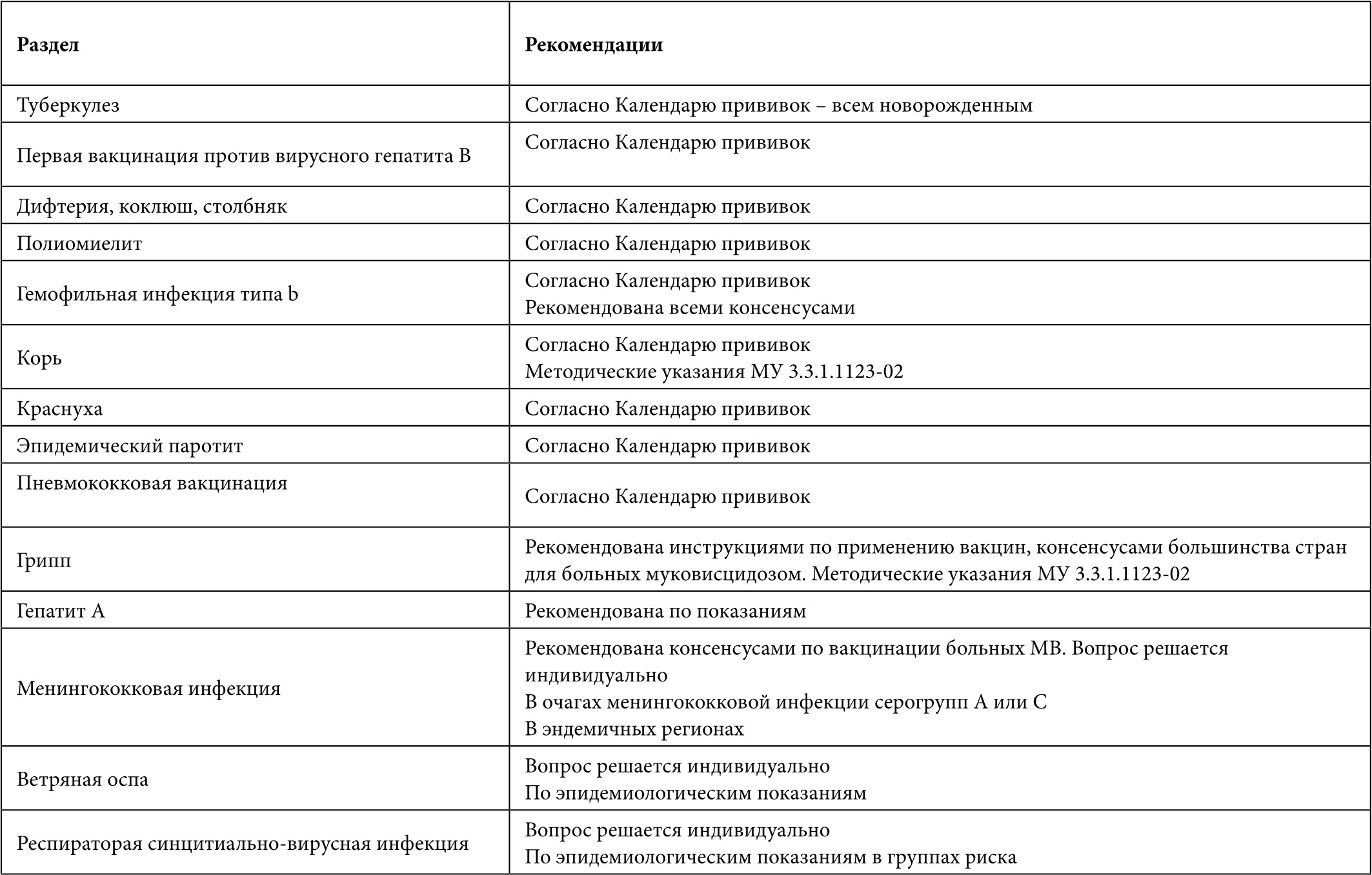
Таблица 1. Вакцинация больных с муковисцидозом (* – данные по применению у взрослых)
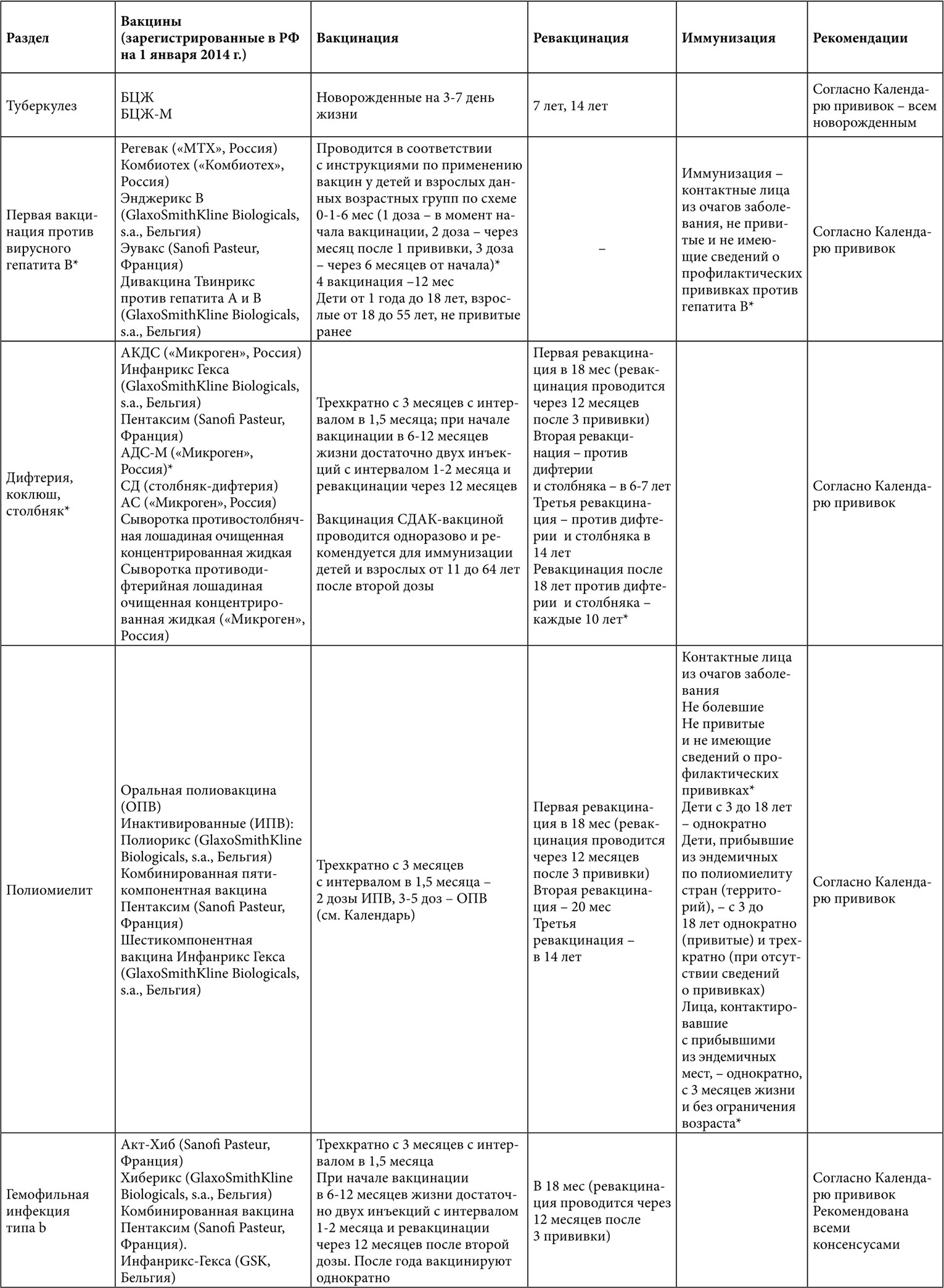
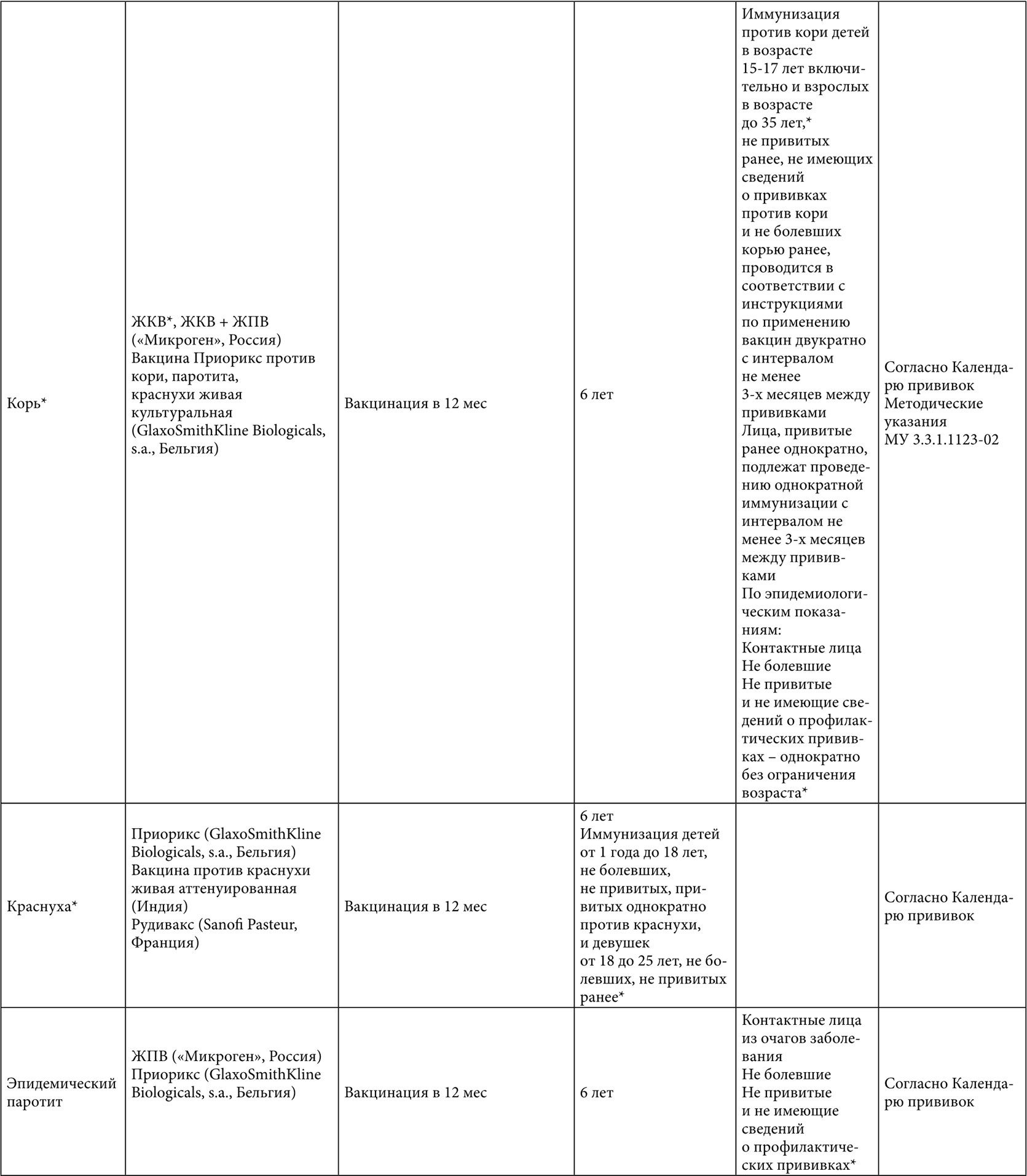
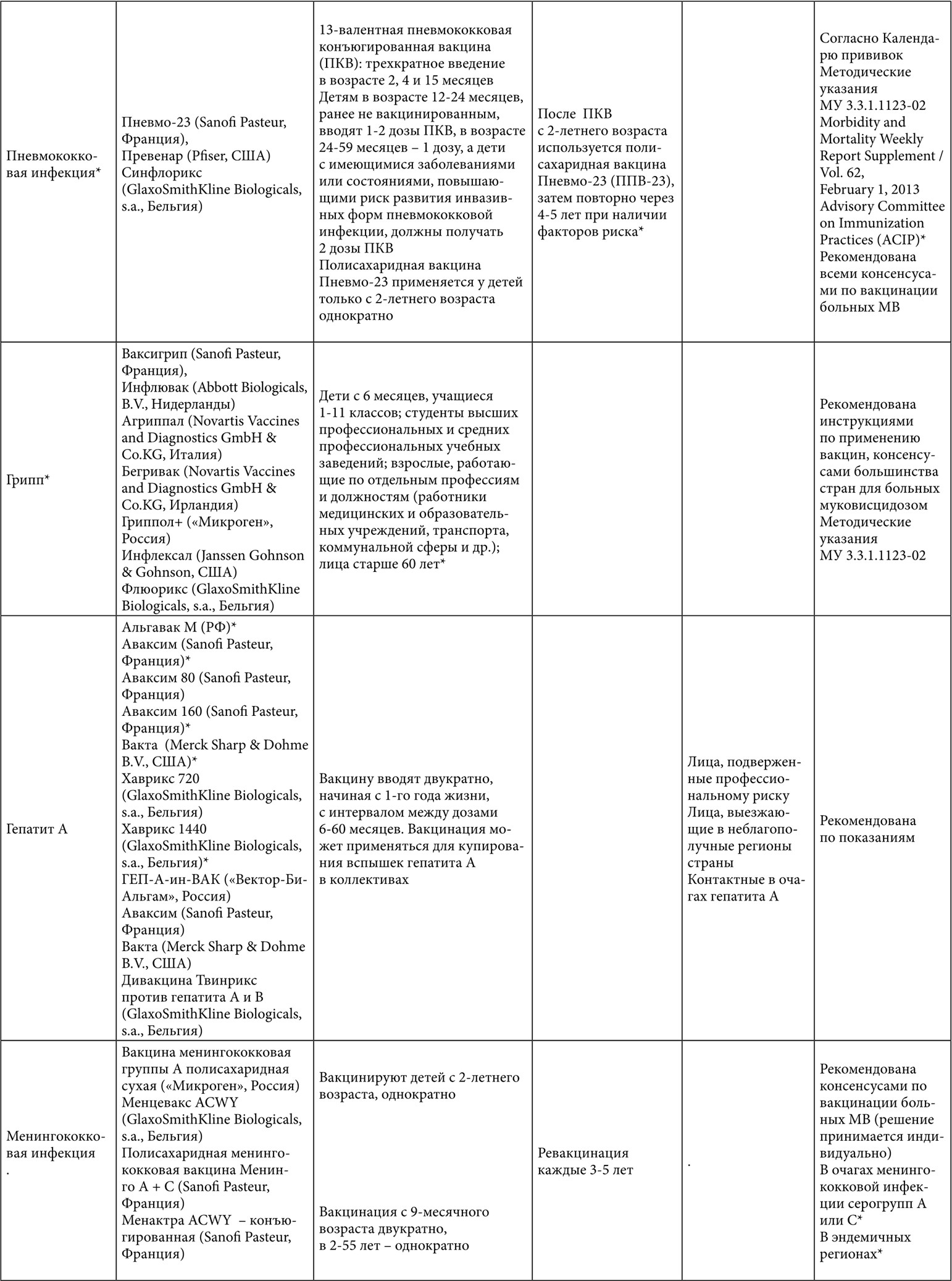
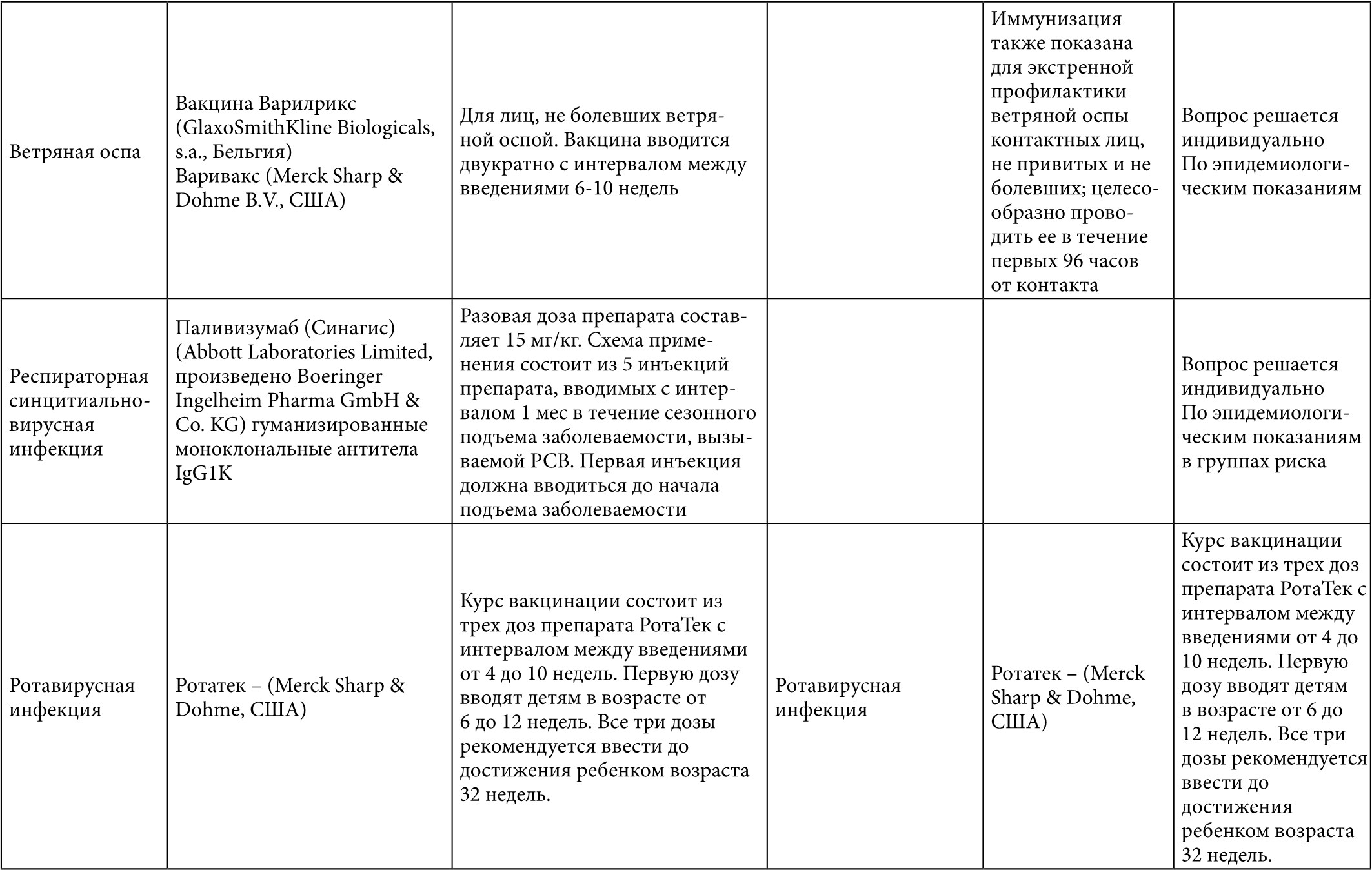
Таблица 2. Вакцинация взрослых больных с муковисцидозом
Литература
1. Приказ МЗ РФ № 125н от 21 марта 2014 года «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям», Приложение № 1.
2. Кондратьева Е.И., Никонова В.С. Иммунизация больных муковисцидозом. Pediatriya named after GN Speransky. 2014; 93 (4): 94-106.
3. Malfroot A., Adam G., Ciofu O., Döring G., Knoope C., Langf А.В., Van Dammeg Р., Daba I., Bush А. Immunisation in the current management of cystic fibrosis patients. J. of Cystic Fibrosis. 2005; 4(2):77-87.
4. Ежлова Е.Б. Эпидемиология и вакцинопрофилактика инфекции, вызываемой Streptococcus pneumoniae: Методические рекомендации. Вакцинация. 2011; 2: 36-47.
5. Pneumococcal. Green Book. 2013; 25 (5): 295-314.
6. Kobayashi M., Bennett N., Gierke R. Intervals Between PCV13 and PPSV23 Vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP). 2015; 64 (34): 944-7.
7. Burgess L., Southern K. Pneumococcal vaccines for cystic fibrosis. Каталог мед. электрон. ресурсов. URL: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD008865.pub3/abstract (дата обращения: 03.08.2016).
8. Костинов М.П. Руководство по клинической иммунологии в респираторной медицине. 1-е изд. М.: ООО «АТМО», 2016: 87-91.
9. Ong E., Bilton D., Abbott J., Webb A., McCartney R., Caul E. Influenza vaccination in adults with cystic fibrosis. BMJ: British Medical Journal. 1991; 303 (7): 6557-6802.
10. Gross P., Denning C., Gaerlan P., Bonelli J., Bernius M., Dran S., Monk G., Vassallo M, Quinnan G., Levandowski R., Cataruozolo P., Wallenstein S. Annual influenza vaccination: immune response in patients over 10 years. 1996; 14(13): 1280-1284.
11. Dharmaraj P., Tan A., Smyth R. Vaccines for preventing influenza in people with cystic fibrosis. The Cochrane Library. 2000.
12. Каширская Н.Ю., Дащинская О.В., Капустина Т.Ю., Воронкова А.Ю., Капранов Н.И. Опыт применения вакцины Инфлювак у детей с муковисцидозом. Фарматека. Инфекционные болезни. Пульмонология. 2003; 13: 74-77.
13. Рыжов А.А. Вакцины PNEUMO-23 и Act-HIB в профилактике и лечении хронических заболеваний легких у детей: Автореф. дис. … канд. мед. наук. М., 2004.
14. Эпидемиология и вакцинопрофилактика инфекции, вызываемой Haemophilus influenzae типа b: Методические рекомендации МР 3.3.1.0001-10. М., 2010.
15. Haemophilus influenzaе type b (Hib) Vaccination Position Paper, weekly epidemiological record. WHO. 2013; 39 (88): 413-28.
16. Cerquetti M,. Giufrè M. Why we need a vaccine for non-typeable Haemophilus influenzaе. Human vaccines & immunotherapeutics. 2016; 1-5.
8. Трансплантация при муковисцидозе
В настоящее время трансплантация жизненно важных органов от донора-трупа или живого родственного донора является единственной реальной альтернативой в лечении терминальных стадий многих хронических заболеваний, в том числе и муковисцидоза (МВ). Несмотря на то что МВ характеризуется мультиорганным поражением, наиболее часто пациенты с МВ становятся реципиентами трансплантации легких и печени.
8.1. Трансплантация легких
МВ является третьим из основных нозологических показаний к трансплантации легких (после ХОБЛ и легочного фиброза), так как пациенты с МВ составляют до 25% от всех реципиентов с наличием трансплантированных легких [1]. А среди детей и подростков, нуждающихся в трансплантации легких, МВ является основным заболеванием (до 65%) [2].
По данным Международного общества трансплантации сердца и легких, реципиенты с МВ демонстрируют наилучшие показатели как ранней, так и поздней выживаемости после трансплантации легких, что в первую очередь обусловлено более молодым возрастом пациентов. Медиана выживаемости пациентов с МВ после трансплантации легких достигает 9 лет, а у тех, кто пережил первый посттрансплантационный год, – 11,7 года. Более длительное выживание, как и у реципиентов других нозологических групп, ограничено высоким риском инфекционных заболеваний пересаженных легких и развитием хронической дисфункции легочных трансплантатов, которая развивается почти у половины реципиентов в течение 5 лет после операции [3].
Результаты педиатрической трансплантации легких у пациентов с МВ в целом соответствуют результатам во взрослой популяции реципиентов [4].
В Российской Федерации к настоящему времени накоплен опыт менее чем 20 операций по трансплантации легких у пациентов с МВ с удовлетворительными показателями ранней выживаемости (умер 1 пациент). Максимальный срок наблюдения за пациентом составляет 4,5 года. Также имеется опыт одной успешной трансплантации легких ребенку 13 лет с МВ и опыт нескольких операций по трансплантации легких у пациентов с МВ и хроническим инфицированием B. cepacia.
Показания к трансплантации легких при МВ
Трансплантация легких показана пациентам с терминальным поражением легких, обусловленным МВ, которые имеют тяжелую дыхательную недостаточность, выраженные функциональные ограничения (3-4-й функциональный класс по NYHA) и риск смерти которых в течение ближайших 2 лет превышает 50%.
Однако следует отметить, что до настоящего времени нет единого мнения о достоверных прогностических факторах смертности у таких пациентов. Наиболее значимым в этом отношении является оценка динамики показателя объема форсированного выдоха за первую секунду (ОФВ1, FEV1) [5], однако значение также имеют возраст пациентов, нутритивный статус, микробиологический мониторинг мокроты, количество госпитализаций по поводу обострений инфекционного процесса и/или частота амбулаторных курсов внутривенной антибактериальной терапии [6], наличие гиперкапнии по данным газового анализа артериальной крови и/или потребность в неинвазивной вентиляции легких [7], оценка толерантности к физической нагрузке и наличие легочной гипертензиии [8, 9, 10, 11].
Показаниями к направлению пациента с МВ в трансплантационный центр для решения вопроса о необходимости трансплантации легких являются:
• снижение объема форсированного выдоха за первую секунду (ОФВ1, FEV1) до 30% от расчетного и менее;
• быстрое снижение показателя объема форсированного выдоха за первую секунду, несмотря на проводимую в полном объеме медикаментозную терапию, с наличием инфицирования дыхательных путей нетуберкулезными микобактериями (в особенности Mycobacterium abscessus) или Burkholderia cepacia complex и/или наличием сахарного диабета;
• дистанция в тесте 6-минутной ходьбы менее 400 метров;
• развитие легочной гипертензии в отсутствие гипоксемической дыхательной недостаточности;
• ухудшение общеклинического состояния пациента за счет учащения эпизодов обострения заболевания, ассоциированных с любым из следующих состояний:
– острая дыхательная недостаточность, требующая неинвазивной вентиляции легких;
– повышение антибиотикорезистентности или неудовлетворительное восстановление общеклинического состояния после очередного обострения заболевания;
– ухудшение нутритивного статуса, несмотря на применение дополнительного энтерального питания;
– пневмоторакс;
– жизнеугрожающее кровохарканье, несмотря на проведение эмболизации бронхиальных артерий.
Показаниями к включению пациента с диагнозом «муковисицидоз» и поражением легких в лист ожидания являются:
• хроническая дыхательная недостаточность:
– изолированная гипоксемическая форма (парциальное давление кислорода в артериальной крови менее 60 мм рт.ст.);
– гиперкапническая форма (парциальное давление двуокиси углерода в артериальной крови более 50 мм рт.ст.);
• длительная (амбулаторная) неинвазивная вентиляция легких;
• легочная гипертензия (систолическое давление в легочной артерии более 35 мм рт.ст. по данным эхокардиографического исследования или среднее давление в легочной артерии более 25 мм рт.ст. по данным катетеризации правых камер сердца);
• частые госпитализации для лечения обострения заболевания;
• быстрое снижение показателей функции внешнего дыхания;
• выраженное ограничение функционального класса (4-й класс по NYHA).
Особые группы пациентов с муковисцидозом
Нетуберкулезный микобактериоз
Нетуберкулезная микобактериальная инфекция (например, Mycobacterium abscessus или Mycobacterium avium complex) у пациентов с муковисцидозом встречается нечасто (не более чем у 10-12% пациентов), однако эти возбудители играют важную роль в ускорении нарушения функции легких [12], а также могут обусловливать тяжелые инфекционные осложнения в послеоперационном периоде после трансплантации легких.
В отношении пациентов с муковисцидозом, инфицированных нетуберкулезными микобактериями, целесообразно придерживаться следующих рекомендаций, основанных на исследованиях отдельных случаев и небольших сериях наблюдений:
• все пациенты с муковисцидозом, которые рассматриваются в качестве потенциальных реципиентов трансплантации легких, должны быть обследованы на нетуберкулезный микобактериоз;
• реципиентам трансплантации легких с муковисицидозом, у которых был диагностирован нетуберкулезный микобактериоз, этиотропное лечение должно быть начато до трансплантации в соответствии с данными микробиологического исследования и существующими рекомендациями по лечению нетуберкулезной микобактериальной инфекции;
• лечение нетуберкулезного микобактериоза у реципиентов трансплантации легких должно проводиться под наблюдением или при участии специалистов, имеющих опыт лечения нетуберкулезной микобактериальной инфекции;
• прогрессирование легочного или внелегочного нетуберкулезного микобактериоза, несмотря на проводимое этиотропное лечение, или невозможность обеспечить адекватную этиотропную терапию нетуберкулезного микобактериоза являются абсолютным противопоказанием к трансплантации легких.
Инфицирование Burkholderia cepacia complex (BCC)
Пациенты с муковисцидозом, инфицированные Burkholderia cepacia complex (BCC), демонстрируют быстро прогрессирующее нарушение легочной функции [13], а также достоверно худшие результаты выживаемости после трансплантации легких в сравнении с пациентами, не имеющими этой инфекции. Burkholderia cepacia complex – это группа 17-ти фенотипически одинаковых видов микроорганизмов (геномовары), из которых наибольшую опасность с точки зрения влияния на выживаемость после трансплантации легких представляет Burkholderia cenocepacia (геномовар III) [14, 15, 16].
В отношении пациентов с муковисцидозом, инфицированных Burkholderia cepacia complex (BCC), целесообразно придерживаться следующих рекомендаций:
• все пациенты с муковисцидозом, которые рассматриваются в качестве потенциальных реципиентов трансплантации легких, должны быть обследованы на инфекцию Burkholderia cepacia complex (BCC);
• при выявлении инфекции Burkholderia cepacia complex (BCC) целесообразно определение геномовара возбудителя для исключения Burkholderia cenocepacia (геномовар III);
• учитывая высокий риск рецидива инфекции Burkholderia cenocepacia (геномовар III) после трансплантации легких, что связано с 70-100%-ной летальностью, выполнение трансплантации легких таким пациентам показано только в тех трансплантационных центрах, которые имеют соответствующий клинический опыт или научно-практические программы по разработке новых методов лечения Burkholderia cepacia complex-инфекции. При этом пациенты должны быть обязательно информированы о рисках трансплантации легких в подобных условиях.
Подготовка к трансплантации легких при МВ
Перед направлением пациента с МВ в трансплантационный центр необходимо убедиться в отсутствии у него абсолютных противопоказаний к трансплантации, а именно:
1. Наличие или анамнез (менее 5 лет наблюдения и ремиссии заболевания после адекватной специфической терапии) злокачественных онкологических заболеваний.
2. Наличие тяжелого, некурабельного заболевания или дисфункции другого жизненно важного органа или системы органов (сердце, печень, почки или центральная нервная система).
3. Острый период заболевания или состояния, сопровождающийся нестабильностью витальных функций организма, (например, сепсис, инфаркт миокарда, нарушение мозгового кровообращения и т.п.), за исключением изолированной дыхательной недостаточности.
4. Наличие некорректируемого нарушения системы гемостаза.
5. Наличие активного туберкулеза любой локализации. 6. Наличие подтвержденных психических расстройств.
7. Наличие в анамнезе повторяющихся и/или длительных периодов несоблюдения медицинских предписаний (документированные данные), сопряженных с риском для собственного здоровья и жизни.
8. Отсутствие адекватной или надежной социальной поддержки.
9. Наличие синдрома зависимости от психоактивных веществ, алкоголя и/или табака (документированный отказ не менее 6 месяцев).
При направлении пациента в трансплантационный центр для решения вопроса о трансплантации легких целесообразно подготовить документы и выполнить следующие исследования:
1. Подробный анамнез с указанием временных интервалов начала оксигенотерапии, неинвазивной вентиляции легких, скорости снижения показателей функции внешнего дыхания (не менее чем за 6-месячный интервал), частоты обострений заболевания за последний год с указанием примененных эффективных схем противомикробной терапии.
2. Последние данные микробиологического исследования мокроты и мазка из носа с данными антибиотикочувствительности.
3. Ультразвуковое исследование сердца с измерением давления в легочной артерии – для исключения легочной гипертензии.
4. Ультразвуковое исследование органов брюшной полости – для исключения портальной гипертензии.
5. Компьютерная томография легких и придаточных пазух носа (не более 6-месячной давности).
6. Консультация (и лечение при необходимости) стоматолога – на предмет санации полости рта.
7. Консультация (и лечение при необходимости) гинеколога – на предмет исключения инфекционной и онкологической патологии.
8. Ультразвуковое исследование подвздошных и бедренных сосудов – для исключения патологии, препятствующей проведению канюль ЭКМО.
Белково-энергетическая недостаточность и истощение очень часто сопутствуют терминальному поражению легких при МВ в связи с наличием у этих пациентов патологии поджелудочной железы, хроническим инфекционным процессом в легких, повышенной работой дыхательной мускулатуры и частым наличием нарушения толерантности к глюкозе. При этом доказано, что низкий индекс массы тела (менее 17 кг/м2) является независимым фактором неблагоприятного прогноза у реципиентов легких как в период нахождения в листе ожидания, так и в послеоперационный период [17]. Таким образом, пациентам с низким индексом массы тела рекомендовано проведение любых мероприятий по коррекции белково-энергетического дефицита, в том числе путем проведения дополнительного энтерального питания через назогастральный зонд или пункционную гастростомическую трубку [18].
Лист ожидания трансплантации легких
При наличии показаний к трансплантации легких (см. выше) пациент включается в лист ожидания, что оформляется документально в соответствии с действующим законодательством.
Во время нахождения пациента в листе ожидания регулярно проводится контроль его клинического состояния:
• каждые 3 месяца для пациентов низкого риска смерти;
• каждые 1-2 месяца для пациентов высокого риска смерти;
• каждые 2 недели для пациентов крайне высокого риска смерти.
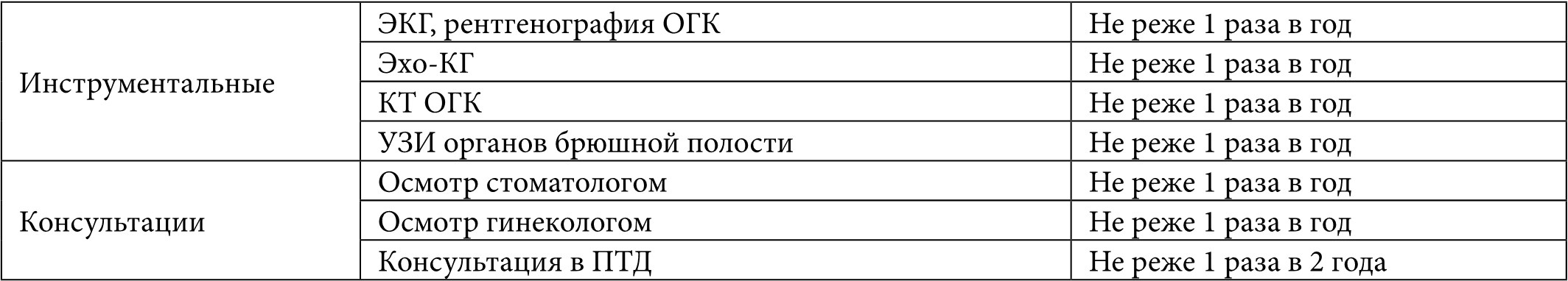
Во время регулярных обследований пациентов, находящихся в листе ожидания, выполняются объективный осмотр, общеклинические лабораторные анализы, инструментальные и дополнительные исследования по показаниям. В ходе динамического регулярного наблюдения реципиентов в листе ожидания особое внимание необходимо уделять признакам и маркерам прогрессирования дыхательной и/или сердечной недостаточности, изменениям нутритивного статуса, динамике изменения функционального состояния и толерантности к физическим нагрузкам, психоэмоциональному состоянию пациента. Кратность выполнения тех или иных исследований для пациентов в листе ожидания трансплантации легких представлена в Таблице 1.
Таблица 1. Частота контроля лабораторно-инструментальных методов обследования реципиентов в листе ожидания трансплантации легких

Наблюдение после трансплантации
Пациенты с МВ после трансплантации легких должны находиться под наблюдением специалиста-трансплантолога для контроля за состоянием пересаженного органа и под наблюдением специалиста по МВ с целью коррекции МВ-ассоциированных состояний, многие из которых могут манифестировать под влиянием посттрансплантационных факторов (как, например, сахарный диабет на фоне терапии глюкокортикоидными гормонами, входящими в протокол иммуносупрессивной терапии).
Литература
1. Yusen R.D., Edwards L.B., Kucheryavaya A.Y., Benden C., Dipchand A.I., Goldfarb S.B., et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Oficial Adult Lung and Heart-Lung Transplantation Report-2015; Focus Theme: Early Graft Failure. J. Heart Lung Transplant. 2015. Oct 10;34(10):1264-77.
2. Benden C., Edwards L.B., Kucheryavaya A.Y., et al. The Registry of the International Society for Heart and Lung Transplantation: sixteenth oficial pediatric lung and heart-lung transplantation report – 2013; focus theme: age. J. Heart Lung Transplant. 2013; 32: 989-997.
3. Lars H. Lund, Leah B. Edwards, Anne I. Dipchand et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Heart Transplantation Report. 2016; Focus Theme: Primary Diagnostic Indications for Transplant. The Journal of Heart and Lung Transplantation. Vol 35, No 10, October 2016: 1170-1184.
4. The Registry of the International Society for Heart and Lung Transplantation: Nineteenth Pediatric Lung and Heart Lung Transplantation Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant. The Journal of Heart and Lung Transplantation, Vol 35, No 10, October 2016: 1185-1195.
5. Rosenbluth D.B., Wilson K., Ferkol T., Schuster D.P. Lung function decline in cystic fibrosis patients and timing for lung transplantation referral. Chest. 2004;126:412-9.
6. Mayer-Hamblett N., Rosenfeld M., Emerson J., Goss C.H., Aitken M.L. Developing cystic fibrosis lung transplant referral criteria using predictors of 2-year mortality. Am. J. Respir. Crit. Care Med. 2002;166: 1550-5.
7. Augarten A., Akons H., Aviram M., et al. Prediction of mortality and timing of referral for lung transplantation in cystic fibrosis patients. Pediatr. Transplant 2001;5:339-42.
8. Kadikar A., Maurer J., Kesten S. The six-minute walk test: a guide to assessment for lung transplantation. J. Heart Lung Transplant. 1997;16: 313-9.
9. Tuppin M.P., Paratz J.D., Chang A.T., et al. Predictive utility of the 6-minute walk distance on survival in patients awaiting lung transplantation. J. Heart Lung Transplant. 2008;27:729-34.
10. Venuta F., Rendina E.A., Rocca G.D., et al. Pulmonary hemodynamics contribute to indicate priority for lung transplantation in patients with cystic fibrosis. J. Thorac. Cardiovasc. Surg. 2000;119:682-9.
11. Venuta F., Tonelli A.R., Anile M., et al. Pulmonary hypertension is associated with higher mortality in cystic fibrosis patients awaiting lung transplantation. J. Cardiovasc. Surg. 2012;53:817-20. 45.
12. Esther C.R., Jr, Esserman D.A., Gilligan P., Kerr A., Noone P.G. Chronic Mycobacterium abscessus infection and lung function decline in cystic fibrosis. J. Cyst. Fibros. 2010;9:117-23.
13. O’Sullivan B.P., Freedman S.D. Cystic fibrosis. Lancet; 2009 May 30;373(9678):1891-904.
14. De Soyza A., Corris P.A. Lung transplantation and the Burkholderia cepacia complex. J. Heart Lung Transplant. 2003;22:954-8.
15. De Soyza A., McDowell A., Archer L., et al. Burkholderia cepacia complex genomovars and pulmonary transplantation outcomes in patients with cystic fibrosis. Lancet 2001;358:1780-1.
16. De Soyza A., Meachery G., Hester K.L., et al. Lung transplantation for patients with cystic fibrosis and Burkholderia cepacia complex infection: a single-center experience. J. Heart Lung Transplant. 2010;29:1395-404.
17. Madill J., Gutierrez C., Grossman J., et al. Nutritional assessment of the lung transplant patient: body mass index as a predictor of 90-day mortality following transplantation. J. Heart Lung Transplant. 2001; 20: 288-296.
18. Williams S.G., Ashworth F., McAlweenie A., Poole S., Hodson M.E., Westaby D. Percutaneous endoscopic gastrostomy feeding in patients with cystic. Gut. 1999;44(1):87-90.
8.2. Трансплантация печени
В течение последних 25 лет трансплантация печени зарекомендовала себя в качестве надежного метода лечения как детей, так и взрослых. С декабря 2004 г. в ФНЦТИО им. академика В.И. Шумакова выполнено 230 трансплантаций трупной печени 222 реципиентам, среди них 12 (5,5%) детей в возрасте до 18 лет, получивших как разделенный трансплантат, так и целый орган.
В ФНЦТИО – наибольший в России опыт родственной трансплантации печени и одна из самых больших в мире программ трансплантации детям раннего возраста. С 2008 г. в Центре выполнено 346 трансплантаций от живого родственного донора (290 – левый латеральный сектор (в том числе 3 в сочетании с почкой), 13 – левая доля печени (в том числе 1 в сочетании с почкой), 43 – правая доля печени (в том числе 3 с почкой)). Показания к трансплантации включали терминальную фазу диффузных болезней печени, фульминантную печеночную недостаточность и новообразования печени [1].



