 Полная версия
Полная версияМуковисцидоз: определение, диагностические критерии, терапия. Национальный консенсус
У детей длительность лечения не определена, рассматривается необходимость продолжения терапии до прекращения роста [14].
Строгих рекомендаций по длительности лечения женщин детородного возраста и мужчин младше 50 лет с вторичным остеопорозом нет.
У взрослых пациентов с первичным остеопорозом рекомендован прием БФ в течение 3 лет для золедроновой кислоты, 5 лет – для других БФ. После этого лечение может быть продолжено при хорошей переносимости и эффективности у пациентов с высоким риском переломов (имеющих в анамнезе переломы позвонков или бедра, продолжающих прием пероральных ГКС). Если в период временной приостановки лечения бисфосфонатом отмечается повышение маркеров костного обмена или снижение МПК, необходимо рассмотреть вопрос о возобновлении терапии остеопороза. Терапия должна быть пересмотрена, если у больного после 5-летнего применения пероральных бисфосфонатов в общем показателе бедренной кости или шейке бедра по Т-критерию ≤ -2,5 SD [18].
Нежелательные явления при применении бисфосфонатовКратковременные нежелательные явления. Применение БФ (пероральных и парентеральных) у больных МВ может сопровождаться появлением «реакции острой фазы» в виде недомогания, костно-мышечных болей, лихорадки, тошноты и рвоты. Обычно они проявляются через 24-72 часа после приема первой дозы, сохраняются в течение нескольких дней, не наблюдаются при повторных пероральных приемах или инфузиях, купируются приемом нестероидных противовоспалительных препаратов. Снижение дозы БФ, как правило, не приводят к уменьшению выраженности «реакции острой фазы».
Бессимптомная гипокальциемия обычно наблюдается на 1-3 день. Поэтому пациенты должны обязательно принимать добавки кальция и витамина D. Нелеченная гипокальциемия, гипофосфатемия, дефицит витамина D, рахит и остеомаляция являются противопоказаниями к терапии БФ [14]. Более серьезные острые побочные эффекты, связанные с терапией (например, увеит), наблюдаются редко.
Нежелательные явления при длительной терапии. Опасения по поводу воздействия БФ на линейный рост у детей не подтвердились, имеются даже сообщения об улучшении темпов роста при долгосрочной терапии бисфосфонатами [14].
У взрослых пациентов хроническое подавление костного обмена имеет два редких, но серьезных осложнения: остеонекроз челюсти и атипичные переломы. С этим связано введение «лекарственных каникул» при длительном лечении бисфосфонатами у взрослых. У детей эти нежелательные явления не описаны. До назначения лечения бисфосфонатами детям и взрослым рекомендуются консультация стоматолога, завершение необходимых инвазивных стоматологических процедур, регулярное обследование у стоматолога во время терапии, а также ежедневная гигиена полости рта [14, 18].
К атипичным переломам, которые на сегодняшний день не описаны у больных МВ, относят переломы, возникающие в подвертельной области и до 5 см ниже края малого вертела, иногда – в средней трети бедренной кости. Они возникают у пациентов, лечившихся бисфосфонатами, обычно более 3 лет (в среднем 7 лет), хотя встречаются пациенты с атипичными переломами, которые никогда не принимали БФ. Это свидетельствует о том, что у больных остеопорозом «фоновый уровень» атипичных переломов (до лечения) не равен нулю. Большинство исследований обнаружили значимую ассоциацию с приемом ГКС и его продолжительностью. Абсолютный риск очень низкий, составляет 3,2-50 случаев на 100 тыс пациенто-лет [18].
Активные метаболиты витамина DАктивные метаболиты витамина D не могут использоваться для лечения недостаточности или дефицита витамина D у взрослых: их прием и последующий метаболизм не сопровождаются ростом концентрации 25(ОН)D сыворотки крови, что затрудняет лабораторный контроль лекарственной терапии [23]. В отличие от нативного витамина D активные метаболиты витамина D (альфакальцидол и кальцитриол) не нуждаются в гидроксилировании в почках. Эти препараты нашли широкое применение в лечении пациентов с хронической болезнью почек, например, на фоне сахарного диабета. Альфакальцидол обладает некоторыми преимуществами по сравнению с кальцитриолом в отношении развития побочных эффектов (реже возникает гиперкальциемия) и продолжительности действия. Активные метаболиты витамина D в качестве средства монотерапии включены в европейские клинические рекомендации по ведению взрослых больных с глюкокортикоидным остеопорозом. Эти препараты могут сочетаться с бисфосфонатами [18]. Терапию необходимо проводить под постоянным контролем концентрации кальция и фосфатов в крови, а также активности щелочной фосфатазы.
Другие потенциальные возможности антиостеопоротической терапии при муковисцидозеДеносумаб – полностью человеческое рекомбинантное IgG2-антитело к лиганду рецептора активатора ядерного фактора каппа-бета (RANKL). Деносумаб с очень высокой специфичностью и аффинностью связывается с RANKL. Его физиологический эффект на RANKL схож с действием эндогенного остеопротегерина (препятствует контакту RANKL с RANK). Таким образом подавляется образование, функционирование и выживание остеокластов и тем самым снижается интенсивность резорбции кости. Препарат (60 мг/1 мл) вводится подкожно 1 раз в 6 месяцев.
Деносумаб зарегистрирован для лечения постменопаузального остеопороза и остеопороза для мужчин. Исследования у больных МВ не проводились. Поскольку RANK и RANKL экспрессируются не только клетками костной ткани, но и клетками иммунной системы, включая активированные Т-лимфоциты, В-клетки и дендритные клетки, большое внимание уделяется анализу частоты различных инфекций при терапии деносумабом. При лечении женщин в постменопаузе детальный клинический анализ всех случаев инфекции показал их гетерогенную этиологию и отсутствие четкой связи с моментом введения препарата или продолжительностью его приема [18].
Терипаратид – препарат для костно-анаболической терапии у взрослых с тяжелым первичным и глюкокортикоидным остеопорозом. Лечение 20 мкг 1 раз в день подкожно проводится не более 2 лет. Описаны случаи эффективного назначения терипаратида (повышение МПК) у взрослых больных МВ [27]. Препарат не рекомендован для лечения детей вследствие риска развития остеосаркомы [14].
Заключение. Рекомендации по диагностике, профилактике и лечению остеопороза у больных МВ основаны на ограниченном числе исследований с небольшими выборками. Большинство заключений по ведению больных является мнением экспертов. Цель дальнейших исследований в этой области – определение групп высокого риска развития остеопороза, совершенствование профилактики и режимов терапии доступными препаратами и поиск новых лекарственных средств для лечения остеопороза у больных МВ.
Литература
1. Остеопороз: Клинические рекомендации. Под ред. О.М. Лесняк, Л.И. Беневоленской. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2009.
2. Aris R.M., Merkel P.A., Bachrach L.K., Borowitz D.S., Boyle M.P., Elkin S.L., Guise T.A., Hardin D.S., Haworth C.S., Holick M.F., Joseph P.M., O'Brien K., Tullis E., Watts N.B., White T.B. Consensus statement: Guide to bone health and disease in cystic fibrosis. J. Clin. Endocrinol. Metab. 2005; 90(3): 1888-96.
3. Красовский С.А. Остеопороз у взрослых больных муковисцидозом. Автореф. дис. … канд. мед. наук. М., 2012.
4. Соболенкова В.С. Системный анализ в ранней диагностике и лечении остеопенического синдрома при муковисцидозе. Автореф. дис. … канд. мед. наук. Тула, 2009.
5. Ашерова И.К. Снижение тяжести течения заболевания, повышение выживаемости и качества жизни больных муковисцидозом на основе совершенствования междисциплинарной специализированной помощи. Автореф. дис. … докт. мед. наук. М., 2013.
6. Капранов Н.И., Капустина Т.Ю. Состояние минеральной плотности костной ткани у пациентов с муковисцидозом. Педиатрия. 2008; 5: 36-41.
7. Симанова Т. В. Клинико-генетические особенности и костный метаболизм у больных муковисцидозом. Автореф. дис. … канд. мед. наук. М., 2009.
8. Горинова Ю.В. Остеопения при хронических болезнях легких у детей. Автореф. дис. … канд. мед. наук. М., 2005.
9. Jacquot J., Delion M., Gangloff S., Braux J., Velard F. Bone disease in cystic fibrosis: new pathogenic insights opening novel therapies. Osteoporos Int. 2016; 27(4):1401-12.
10. Le Henaff C., Mansouri R., Modrowski D., Zarka M., Geoffroy V., Marty C., Tarantino N., Laplantine E., Marie P.J. Increased NF-κB Activity and Decreased Wnt/β-Catenin Signaling Mediate Reduced Osteoblast Differentiation and Function in ΔF508 Cystic Fibrosis Transmembrane Conductance Regulator (CFTR). Mice. J. Biol. Chem. 2015;290(29):18009-17.
11. Delion M., Braux J., Jourdain M.L., Guillaume C., Bour C., Gangloff S., Pimpec-Barthes F.L., Sermet-Gaudelus I., Jacquot J., Velard F. Overexpression of RANKL in osteoblasts: a possible mechanism of susceptibility to bone disease in cystic fibrosis. J. Pathol. 2016; 240(1):50-60.
12. Gore A.P., Kwon S.H., Stenbit A.E. A roadmap to the brittle bones of cystic fibrosis. J. Osteoporos. 2010; 2011:926045.
13. King S.J., Topliss D.J., Kotsimbos T., Nyulasi I.B., Bailey M., Ebeling P.R., Wilson J.W. Reduced bone density in cystic fibrosis: ∆F508 mutation is an independent risk factor. Eur Respir J. 2005; 25 (1): 54-61.
14. Ward L.M., Konji V.N., Ma J. The management of osteoporosis in children. Osteoporos Int. 2016; 27(7):2147-79.
15. Gordon C.M., Leonard M.B., Zemel B.S.; International Society for Clinical Densitometry. 2013 Pediatric Position Development Conference: executive summary and reflections. J. Clin. Densitom. 2014; 17 (2): 219-24.
16. Скрипникова И.А., Щелягина Л.А., Новиков В.Е., Косматова О.В., Абирова А.С. Возможности костной рентгеновской денситометрии в клинической практике: Методические рекомендации. 2-е изд., доп. М., 2015.
17. Sermet-Gaudelus I., Bianchi M.L., Garabédian M., Aris R.M., Morton A., Hardin D.S., Elkin S.L., Compston J.E., Conway S.P., Castanet M., Wolfe S., Haworth C.S. European cystic fibrosis bone mineralisation guidelines. J. Cyst. Fibros. 2011; 10 Suppl. 2: S16-23.
18. Остеопороз: Руководство для врачей. Под ред. О.М. Лесняк. М.: ГЭОТАР-Медиа, 2016.
19. 2015 ISCD Oficial Positions – Adult: http://www.iscd.org/oficial-positions/2015-iscd-oficial-posi-tions-adult/ (дата обращения: 27.12.2016).
20. Клинические рекомендации по профилактике и ведению больных с остеопорозом. Издание 2-е, дополненное. Под ред. О.М. Лесняк. Ярославль: ИПК «Литера», 2016.
21. Lee J., Vasikaran S. Current recommendations for laboratory testing and use of bone turnover markers in management of osteoporosis. Ann. Lab. Med. 2012; 32 (2):105-12.
22. Tangpricha V., Kelly A., Stephenson A., Maguiness K., Enders J., Robinson K.A., Marshall B.C., Borowitz D. Cystic Fibrosis Foundation Vitamin D Evidence-Based Review Committee. An update on the screening, diagnosis, management, and treatment of vitamin D deficiency in individuals with cystic fibrosis: evidence-based recommendations from the Cystic Fibrosis Foundation. J. Clin. Endocrinol. Metab. 2012; 97(4):1082-93.
23. Профилактика, диагностика и лечение дефицита витамина D и кальция среди взрослого населения и у пациентов с остеопорозом. Под ред. О.М. Лесняк. М.: ГЭОТАР-Медиа, 2016.
24. Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации: Методические рекомендации МР 2.3.1.2432-08, 2008.
25. EFSA Panel on Dietetic Products Nutrition and Allergies. Scientific opinion on dietary reference values for calcium. EFSA J. 2015;13(5): 4101e83. Doi:10.2903/j.efsa.2015.4101.
26. Conwell L.S., Chang A.B. Bisphosphonates for osteoporosis in people with cystic fibrosis. Cochrane Database Syst. Rev. 2014 Mar 14;(3):CD002010.
27. Siwamogsatham O., Stephens K., Tangpricha V. Evaluation of teriparatide for treatment of osteoporosis in four patients with cystic fibrosis: a case series. Case Rep. Endocrinol. 2014: 893589.
28. Lekamwasam S., Adachi J.D., Agnusdei D., Bilezikian J., Boonen S., Borgström F., Cooper C., Diez Perez A., Eastell R., Hofbauer L.C., Kanis J.A., Langdahl B.L., Lesnyak O., Lorenc R., McCloskey E., Messina O.D., Napoli N., Obermayer-Pietsch B., Ralston S.H., Sambrook P.N., Silverman S., Sosa M., Stepan J., Suppan G., Wahl D.A., Compston J.E.; Joint IOF-ECTS GIO Guidelines Working Group. A framework for the development of guidelines for the management of glucocorticoid-induced osteoporosis. 2012; 23(9): 2257-76.
29. Лесняк О.М., Баранова И.А., Торопцова Н.В. Клинические рекомендации «Диагностика, профилактика и лечение глюкокортикоидного остеопороза у мужчин и женщин 18 лет и старше». Ярославль: ИПК «Литера», 2014.
30. Watts N.B., Adler R.A., Bilezikian J.P., Drake M.T., Eastell R., Orwoll E.S., Finkelstein J.S.; Endocrine Society. Osteoporosis in men: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2012 Jun; 97(6): 1802-22. Doi: 10.1210/jc. 2011-3045.
31. Whyte M.P., McAlister W.H., Novack D.V., Clements K.L., Schoenecker P.L., Wenkert D. Bisphosphonate-induced osteopetrosis: novel bone modelling defects, metaphyseal osteopenia, and osteosclerosis fractures after drug exposure ceases. J. Bone Miner Res. 2008;23:1698–707.
32. Ward L., Tricco A.C., Phuong P., Cranney A., Barrowman N., Gaboury I., Rauch F., Tugwell P., Moher D. Biphosphonate therapy for children and adolescents with secondary osteoporosis. Cochrane Database Syst. Rev. 2007; CD005324. Поступила 26.12.2016.
33. Rosenblatt R.L. Lung transplantation in cystic fibrosis. Respir Сare. 2009, 54 (6): 777-87.
6.2. Муковисцидоз-ассоциированный сахарный диабет
Сахарный диабет (СД) – заболевание обмена веществ различной этиологии, которое характеризуется хронической гипергликемией, возникающей в результате нарушения секреции инсулина, действия инсулина или обоих факторов одновременно. Хроническая гипергликемия при СД сопровождается повреждением, дисфункцией и недостаточностью различных органов, особенно глаз, почек, нервов, сердца и кровеносных сосудов [1, 2].
6.2.1. Распространенность и характеристика
С улучшением терапевтических возможностей растет продолжительность жизни пациентов с муковисцидозом – медиана 39,5 года за период 2003-2012 гг. В связи с этим диагностируются новые состояния, такие как нарушение толерантности к глюкозе (НТГ) и муковисцидоз-ассоциированный сахарный диабет (МЗСД). Распространенность МЗСД варьируется в зависимости от использующегося скринига и диагностических критериев [1]. Более 50% пациентов старше 30 лет имеют МЗСД [6]. Медиана дебюта диабета – 18-21 год, распространенность МЗСД у детей младше 10 лет низкая, за каждые последующие 5 лет жизни риск развития МЗСД увеличивается на 5% [3]. Согласно Российскому регистру пациентов с муковисцидозом, частота МЗСД составляет 20,9%, нарушений углеводного обмена – 45%. По данным США, нормальную толерантность к углеводам имеют 50% детей и 25% взрослых [3]. Частота диабета, по данным Европейского регистра 2000 г., возрастает от 5% у детей 10-14 лет до 12,6% у подростков 15-19 лет. Частота МЗСД выше среди женщин и пациентов с мутациями I-III классов на фоне экзокринной недостаточности поджелудочной железы [3]. Средняя продолжительность жизни пациентов с МЗСД ниже по сравнению с пациентами без диабета, медиана выживаемости у пациентов с МЗСД – 24 года по сравнению с 32 годами у пациентов с муковисцидозом, но без диабета. Сахарный диабет увеличивает риск смерти пациентов с муковисцидозом в период ожидания трансплантации легких [5]. За 2-4 года до манифестации диабета ухудшаются показатели нутритивного статуса, дыхательной функции [6].
МЗСД признан ВОЗ как отдельная нозология. В этиологической классификации сахарного диабета (ISPAD, 2009) сахарный диабет при МВ относится к 3-й группе: «III. Другие специфические типы сахарного диабета. С. Болезни экзокринной части поджелудочной железы».
МЗСД имеет черты как СД 1-го типа, так и СД 2-го типа, но определенно отличается от них, что обусловливает уникальный подход к диагностике и лечению заболевания [1] (Табл. 1).
Таблица 1. Сравнительная характеристика различных типов диабета
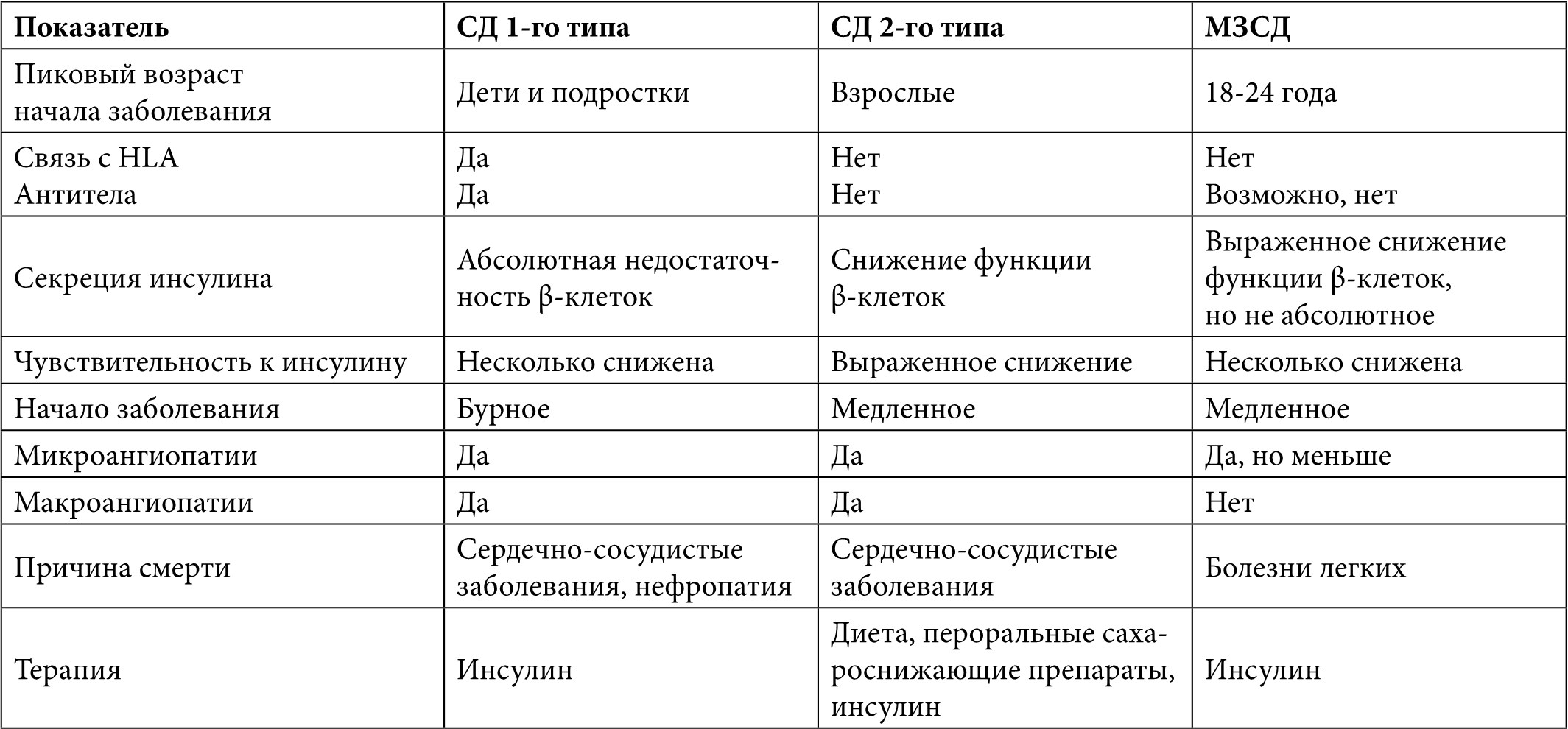
6.2.2. Патофизиология сахарного диабета, обусловленного муковисцидозом
МЗСД чаще возникает у пациентов с МВ с тяжелыми мутациями (I-III классы) и у лиц женского пола. По данным Европейского регистра, у 20% пациентов с мутациями I-III классов развился МЗСД и только у 1,5% – с мутациями IV и V классов. Нет тесной связи между развитием МЗСД и семейным анамнезом в отношении сахарного диабета 1-го типа (СД 1-го типа). Антитела, встречающиеся в дебюте СД 1-го типа, выявляются и у некоторых пациентов с МЗСД, в их образовании может играть роль бактериальная иммунизация. Не установлена ассоциация со II классом НLA (главный комплекс гистосовместимости). Известно, что группа генов НLA предрасполагает к развитию СД 1-го типа. Отложения амилоида в β-клетках, характерные для СД 2-го типа, были найдены у 17% пациентов с муковисцидозом и НТГ и у 69% с МЗСД. Непонятно, способствует ли амилоид разрушению β-клеток, или является маркером заболевания [3].
Ключевая особенность МЗСД – дефицит инсулина с переменной инсулинорезистентностью. Прогрессирование фиброза поджелудочной железы приводит к потере функциональной активности ее эндокринных клеток, секретирующих инсулин, глюкагон, панкреатические пептиды.
Роль инсулиновой недостаточности узучается: известно, что первичный дефект при МЗСД достаточно тяжелый, но абсолютной недостаточности инсулина нет. Уровни инсулина и С-пептида натощак в пределах нормальных величин, но отмечается задержка пиковой секреции инсулина при ОГТТ [3, 6, 8, 9]. Отсроченная секреция инсулина связана с утратой первой фазы секреции инсулина, которая выявляется даже у пациентов с нормальной глюкозотолерантностью, отмечается частичная утрата секреторной ответной реакции глюкагона [1].
Роль инсулинорезистентности изучается. Известно, что у пациентов с муковисцидозом без сахарного диабета чувствительность к инсулину очень вариабельна – может меняться от нормальной до сниженной (инфекции, терапия стероидами, тяжелый дефицит массы тела, дисфункция печени, беременность увеличивают инсулинорезистентность) [3]. У пациентов с муковисцидозом есть инсулинорезистентность, обусловленная снижением периферической утилизации глюкозы и ухудшением инсулиновой супрессии продукции глюкозы печенью [1].
6.2.3. Клиническая характеристика сахарного диабета, обусловленного муковисцидозом
МЗСД развивается постепенно, и у пациентов годами может не быть клинической симптоматики.
Симптомы, которые могут указывать на наличие МЗСД:
• Полиурия или полидипсия
• Невозможность увеличения или поддержания определенной массы тела, несмотря на увеличение питания
• Нарушение роста
• Задержка пубертата
• Необъяснимое ухудшение легочной функции
Диабетический кетоацидоз встречается редко, преимущественно вследствие сохранной секреции инсулина и нарушения секреции глюкагона. Гипергликемия часто присутствует в ситуациях с повышенной инсулинорезистентностью – при обострении легочной инфекции, терапии глюкокортикоидами, гипералиментации, при режимах иммуносупрессивной терапии после трансплантации.
Гипогликемия чаще встречается и протекает тяжелее у пациентов с заболеваниями печени. У молодых, с сохранной функцией печени чаще отмечается гипогликемия натощак. Реактивная гипогликемия может отмечаться у пациентов с муковисцидозом с нарушенной толерантностью к углеводам, в связи с чем полезно распределить прием углеводов равномерно в течение дня [1, 3, 4].
6.2.4. Выживаемость и прогноз
Средняя продолжительность жизни пациентов с МЗСД ниже по сравнению с пациентами без диабета, медиана выживаемости у пациентов с МЗСД – 24 года, по сравнению с 32 годами у пациентов с муковисцидозом, но без диабета. Сахарный диабет увеличивает риск смерти у пациентов с муковисцидозом в период ожидания трансплантации легких [5]. За 2-4 года до манифестации диабета ухудшаются показатели нутритивного статуса, дыхательной функции [6]. Ухудшение со стороны легких коррелирует со степенью исходной инсулиновой недостаточности [1]. Возможная анаболическая роль инсулина может иметь большие последствия при муковисцидозе, чем метаболические эффекты гипергликемии. Микроангиопатические осложнения редки до 10 лет длительности заболевания с гипергликемией натощак, а без гипергликемии натощак – до 14 лет [1]. Макроангиопатические осложнения при МЗСД до настоящего времени не описаны [1].
6.2.5. Диагностика
Возраст начала скрининга для выявления нарушений углеводного обмена у пациентов с муковисцидозом – 10 лет.
• Глюкоза плазмы натощак (ГПН) ≥ 7,0 ммоль/л – критерий сахарного диабета. Но нормальные значения ГПН не могут надежно исключить МЗСД, т.к. большинство пациентов не имеют гипергликемии натощак. Согласно исследованиям, только 16% пациентов с МЗСД выявлены при помощи данного метода.
• Случайно определенное значение гликемии в течение суток ≥ 11,0 ммоль/л плюс симптомы диабета могут служить критерием диагностики диабета.
• Гликированный гемоглобин (НbА1с). В 2011 г. ВОЗ одобрила возможность использования НbА1с для диагностики сахарного диабета [2]. При муковисцидозе определение уровня НbА1с не является надежным методом диагностики сахарного диабета. Только у 16% пациентов повышен уровень НbА1с к моменту постановки диагноза МЗСД [1, 4]. Уровень НbА1с > 6,5% подозрителен на развитие сахарного диабета.
• Продолжительный мониторинг уровня гликемии с использованием приборов CGMS (Continuous Glucose Monitoring System). Данный метод используется во многих европейских центрах муковисцидоза. Может быть полезен при постановке диагноза МЗСД совместно с результатами орального глюкозотолерантного теста (ОГТТ) и клинической симптоматикой. Недостаток – высокая стоимость прибора для мониторинга глюкозы и расходных материалов к нему.
• ОГТТ является стандартным тестом для диагностики МЗСД во многих центрах. ОГТТ следует проводить утром на фоне не менее чем 3-дневного неограниченного питания (более 150 г углеводов в сутки) и обычной физической активности. Тесту должно предшествовать ночное голодание в течение 8-14 часов (можно пить воду). Последний вечерний прием пищи должен содержать 30-50 г углеводов. После забора крови натощак испытуемый должен не более чем за 5 мин выпить 75 г безводной глюкозы или 82,5 г моногидрата глюкозы, растворенных в 250-300 мл воды. Для детей нагрузка составляет 1,75 г безводной глюкозы на 1 кг массы тела, но не более 75 г. В процессе теста не разрешается курение. Через 2 часа осуществляется повторный забор крови. Для предотвращения гликолиза и ошибочных результатов определение концентрации глюкозы проводится сразу после взятия крови, или кровь должна быть центрифугирована сразу после взятия, или храниться при температуре 0-4 °С, или быть взята в пробирку с консервантом (флуорид натрия) [2]. ОГТТ не проводится: на фоне острого заболевания, на фоне кратковременного приема препаратов, повышающих уровень гликемии (глюкокортикоиды, тиреоидные гормоны, тиазиды, бета-адреноблокаторы и др.).
Вследствие нарушения первой фазы секреции инсулина (сдвиг секреции на 60-90 минут) при муковисцидозе характерно повышение глюкозы плазмы в нестандартных точках ОГТТ. Повышение глюкозы плазмы через 1 час после нагрузки глюкозой (ГП1) коррелирует с ухудшением показателей ИМТ и ОФВ1, повышение ГП1 можно рассматривать как ранний маркер нарушений углеводного обмена при муковисцидозе [8, 9].
6.2.6. Диагностические критерии МЗСД [1, 2, 4, 6]
Модифицированные критерии диагностики были разработаны Комитетом по сахарному диабету при муковисцидозе Северной Америки в 1998 г. при описании МЗСД с или без гипергликемии натощак (уровень глюкозы плазмы натощак). На основании предположения о том, что прогноз при муковисцидозе может различаться между двумя этими группами, выявлена взаимосвязь между показателями ИМТ, ОФВ1 и значением глюкозы плазмы через 2 часа в ходе ОГТТ, а также взаимосвязь между гипергликемией натощак и микрососудистыми осложнениями [4, 6]. Самые ранние изменения варьируются: за периодической постпрандиальной гипергликемией следует нарушенная толерантность к глюкозе, далее диабет без гипергликемии натощак переходит в диабет с тощаковой гипергликемией. Диагноз ненарушенной глюкозотолерантности в пероральном глюкозотолерантном тесте не исключает аномальных постпрандиальных уровней глюкозы крови в домашних условиях (когда употребляется гораздо больше 75 граммов углеводов).



