 Полная версия
Полная версияПолная версия:
Муковисцидоз: определение, диагностические критерии, терапия. Национальный консенсус
При выборе антибиотика, как при первичном высеве, так и для лечения обострения бронхолегочного процесса, необходимо руководствоваться следующим [79–81]:
1) комбинация из трех препаратов является более эффективной, курс от 3-х недель и более;
2) целесообразной является комбинация внутривенного и ингаляционного путей и/или перорального введения антибактериальных препаратов;
3) наибольшую активность in vitro сохраняют цефтазидим, пиперациллин/тазобактам, меропенем, имипенем, ко-тримоксазол и тетрациклины. В клинических исследованиях наиболее эффективны меропенем, тобрамицин, ко-тримоксазол, пиперациллин/тазобактам, доксициклин и цефтазидим. Для оптимизации исходов сепация-синдрома рекомендуется обязательное включение в схему лечения ко-тримоксазола [77, 78]. Эффективно применение трехкомпонентной схемы внутривенного введения меропенема и тобрамицина с цефтазидимом в течение 2 недель и более (см. Табл. 4) [45, 79];
4) эффективна длительная, от 3 до 12 недель, терапия пероральными препаратами – ко-тримоксазолом, и/или доксициклином, и/или хлорамфениколом (на фоне внутривенной терапии или после нее). При хронической инфекции Burkholderia cepacia complex рекомендуется прием таблетированных форм ко-тримоксазола;
5) большинство микроорганизмов Burkholderia cepacia complex демонстрирует резистентность к антипсевдомонадным антибиотикам, включая природную резистентность к колистину и АМГ. В то же время накоплена информация об эффективности применения тобрамицина [45, 79, 80];
6) в ряде случаев при крайне тяжелом течении болезни допустимо сочетание двух лактамных антибиотиков (внутривенно и ингаляционно).
Для детей старше 12 лет и взрослых Европейским и Североамериканским консенсусами рекомендовано ингаляционное применение тобрамицина, меронема и цефтазидима, предназначенных для внутривенного использования (уровень доказательности низкий, класс рекомендаций – D) [81].
Возможно применение ацетилцистеина – тиамфеникола в ингаляциях (класс рекомендаций – D).
Об эрадикации Burkholderia cepacia complex можно судить только через год после последнего высева при условии как минимум трех отрицательных бактериологических анализов мокроты.
В отношении больных, высевающих Burkholderia cepacia complex, проводится политика строжайшего инфекционного контроля и гигиенических мер.
12. АБТ при высеве из бронхиального секрета Achromobacter sppРоль Achromobacter spp. при МВ окончательно не определена, в связи с чем четкой стратегии относительно сроков и объема лечения не разработано. Повторный высев Achromobacter spp., сопровождающийся увеличением продукции специфических преципитирующих антител, ассоциируется с более быстрым падением легочной функции, сопоставимым с таковым при хронической синегнойной инфекции [82]. К возникновению заболевания предрасполагает иммунодефицит.
Общие правила антимикробной терапии:
1) при первом высеве и/или связи его с обострением бронхолегочного процесса используют внутривенные антибиотики курсом 14–21 день. Назначается внутривенная терапия и в ингаляциях колистином на 3 месяца, возможно с пероральными антибиотиками. Можно использовать ко-амоксиклав (ко-тримоксазол) в течение 1 месяца и ингаляции колистина в течение 3 месяцев;
2) при хронической инфекции используются длительно ингаляции колистина (1-я линия), при отсутствии эффекта назначают ингаляции меропенема (2-я линия);
3) Achromobacter spp. характеризуется мультирезистентностью, способностью формировать биопленки, объясняющей неудачи антибактериальной эрадикационной терапии микроорганизма при хронической инфекции;
4) согласно международным рекомендациям, для лечения обострений, обусловленных Achromobacter xylosoxidans, используют комбинацию двух антисинегнойных антибиотиков различных классов (см. Табл. 4) [80, 83].
Таблица 5. Антибиотики, применяемые при высеве Burkholderia cepacia complex, Achromobacter xylosoxidans
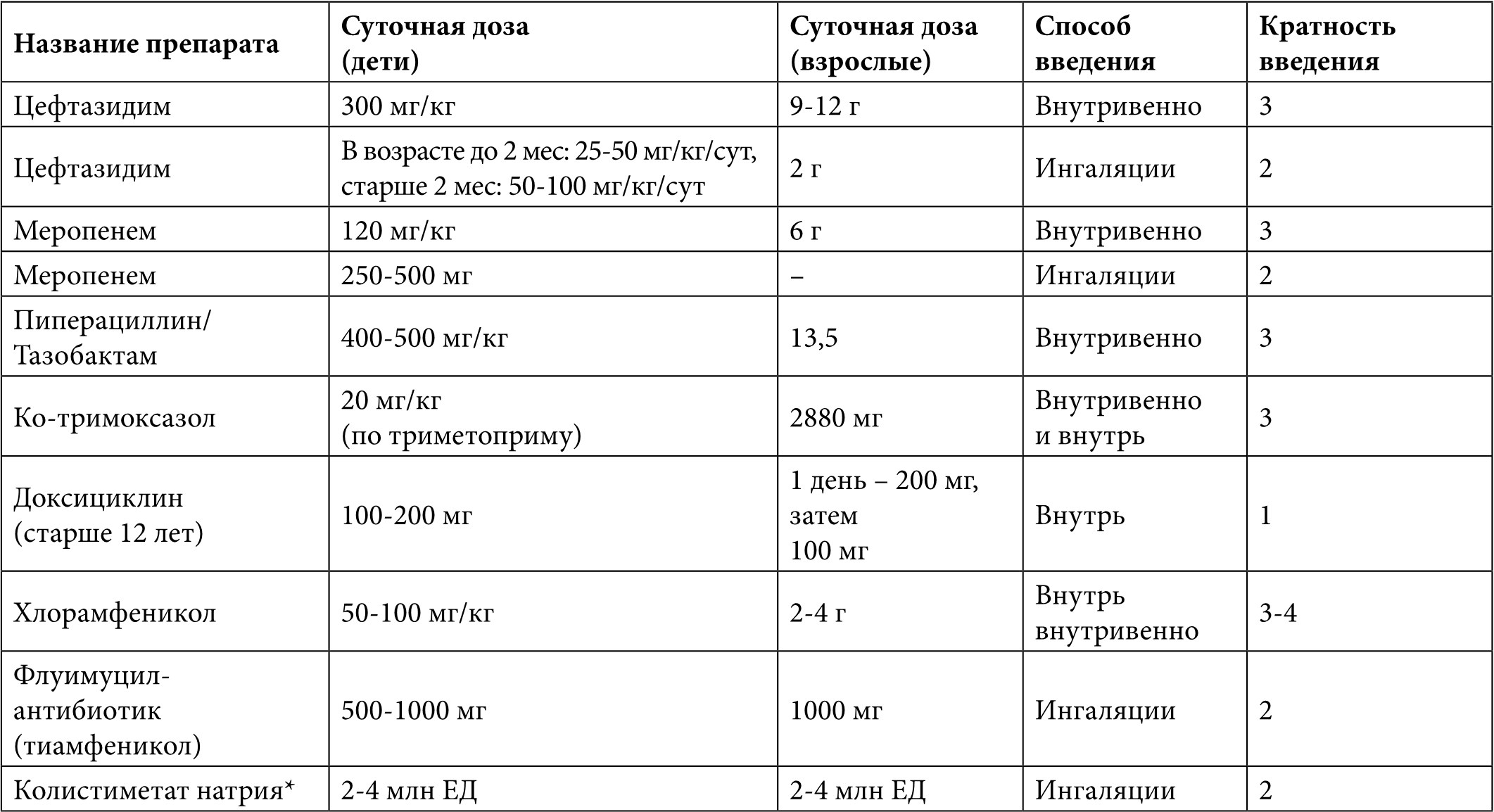
* Для Achromobacter xylosoxidans
13. АБТ при высеве из бронхиального секрета Stenotrophomonas maltophilia
Распространенность Stenotrophomonas maltophilia очень варьируется, достигая в некоторых центрах МВ 25% [84]. Данные о ее клинической значимости противоречивы. Хроническая инфекция Stenotrophomonas maltophilia является предиктором более частых обострений легочной инфекции, но не оказывает существенного негативного влияния на легочную функцию [85]. В этой связи вопрос о необходимости первичной эрадикации этого возбудителя не рассматривается. Особенности АБТ представлены в Таблице 5.
Таблица 6. Антибиотики, применяемые при высеве Stenotrophomonas spp.
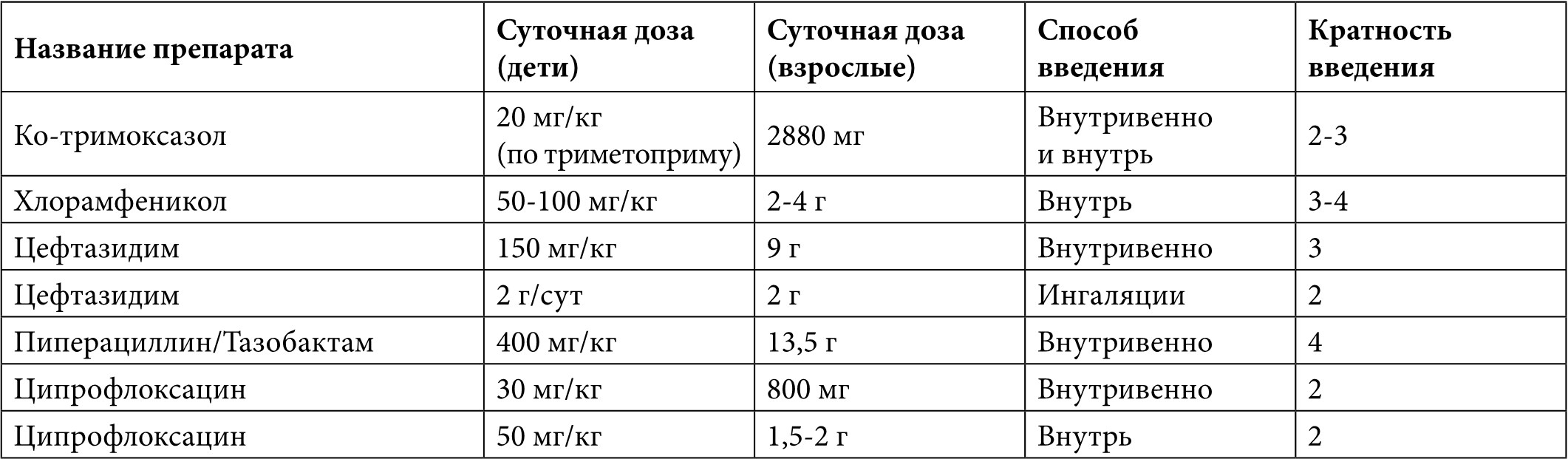
1) Stenotrophomonas maltophilia характеризуется отсутствием чувствительности к карбапенемам, высоким уровнем резистентности к азтреонаму, АМГ, тазобактаму, колистину;
2) наиболее активным в отношении большинства изолятов является ко-тримоксазол;
3) лечение зависит от клинической ситуации. При легких проявлениях бронхолегочного процесса возможно пероральное назначение антибиотика (ко-тримоксазол, хлорамфеникол). Для детей старше 12 лет может быть назначен в качестве альтернативы доксициклин;
4) так как ко-тримоксазол обладает бактериостатическим действием, то при лечении клинически значимых инфекций требуется комбинация препаратов с бактерицидным действием и назначение внутривенной АБТ. Рациональной является комбинация ко-тримоксазола с тикарциллином-клавуланатом или цефтазидимом [80];
5) курс терапии составляет 2-4 недели.
Клинических исследований, определяющих наиболее эффективные режимы АБТ при повторных высевах, не проводилось.
14. Ингаляционная терапия хронической инфекции дыхательного тракта при МВИнгаляционная терапия разработана для эрадикации (п. 10.4) и терапии хронической Pseudomonas aeruginosa-инфекции (п. 10.5 – контроль за инфекцией) [86]. При хронической инфекции используют тобрамицин в форме раствора для ингаляций (Брамитоб, 300 мг) или в форме порошка (Тоби Подхалер, 112 мг) дважды в сутки интермиттирующими курсами: 28 дней приема, 28 дней перерыва, всего 6 курсов в год (уровень доказательности рекомендаций – высокий, класс рекомендаций – А) или раствор колистиметата натрия (Колистин) 2-4 млн ЕД в сутки постоянно. Азтреонам (Cayston Aztreonam lysine производства Corus Pharma, Inc.) – антибактериальный ингаляционный препарат для лечения инфекции, вызванной Pseudomonas aeruginosa, при муковисцидозе. В РФ назначается индивидуально при непереносимости тобрамицина и колистина или резистентности к ним. Суточная доза – 75 мг 3 раза в день, всего 225 мг в день. Потребность в год: 6 курсов по 28 дней. При отсутствии данных препаратов возможно временное использование растворов для внутривенного применения ингаляционно: гентамицина, амикацина или бруламицина (Табл. 6). При микозах возможно применение амфотерицина, при Staphylococcus aureus и Burkholderia cepacia complex – флуимуцила или антибактериальных препаратов для внутривенного введения (на основании зарубежных консенсусов и российского опыта) (Табл. 7). Однако в настоящее время нет доказательных исследований по их применению [20]. Характеристика доказательности рекомендаций рассматривалась нами согласно общепринятой методике (Табл. 8).
Таблица 7. Ингаляционные антибиотики при хронической инфекции дыхательного тракта у больных муковисцидозом
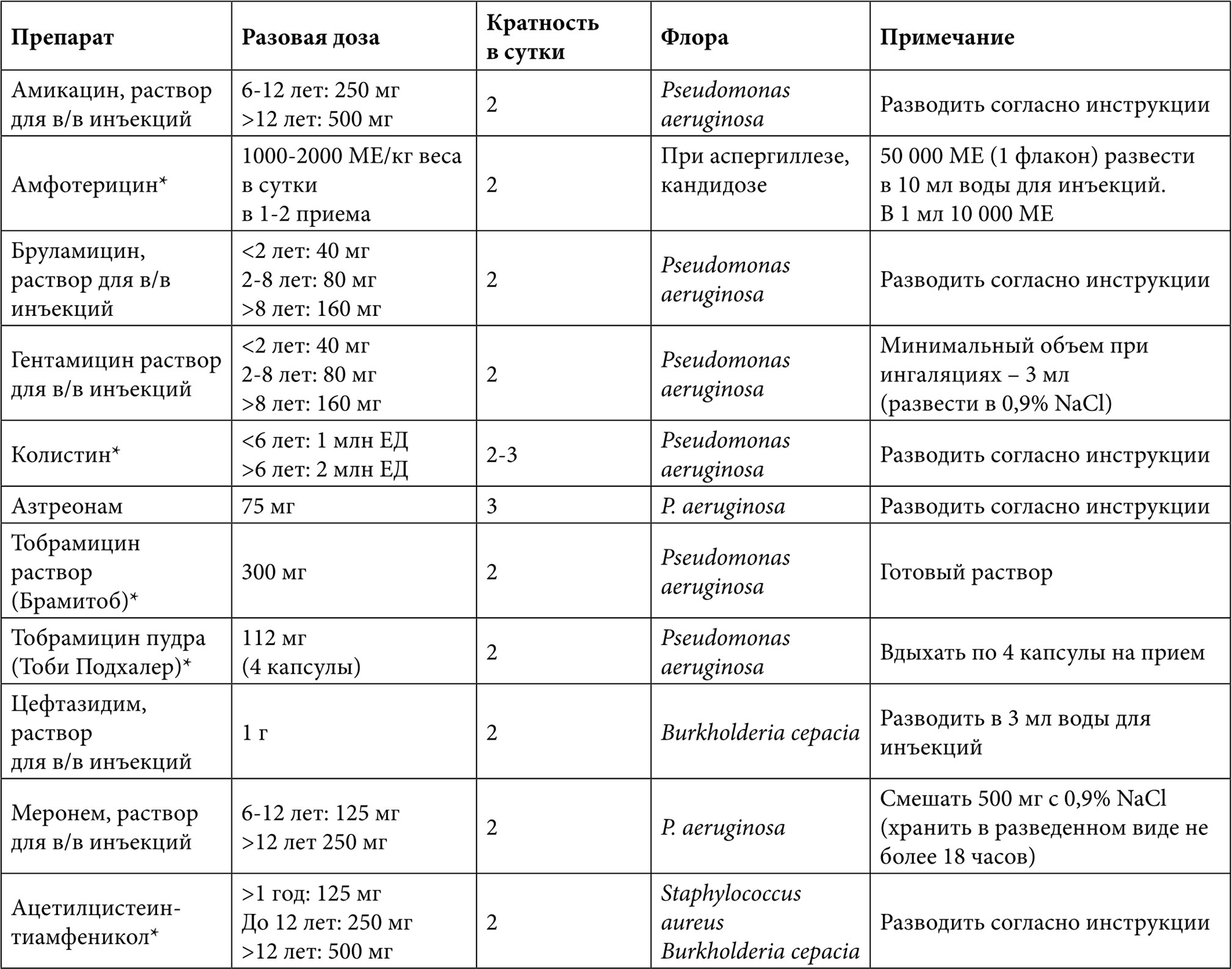
Примечание: * Ингаляционные формы антибиотиков
15. Рекомендации для назначения АБТ с учетом критериев доказательной медицины
Рекомендации по применению АБТ представлены в Таблице 8 согласно Североамериканскому консенсусу 2007 г. и 2013 г. [12, 20] с учетом характеристики доказательности рекомендаций (Табл. 8).
Таблица 8. Рекомендации для назначения антибактериальной терапии при муковисцидозе9
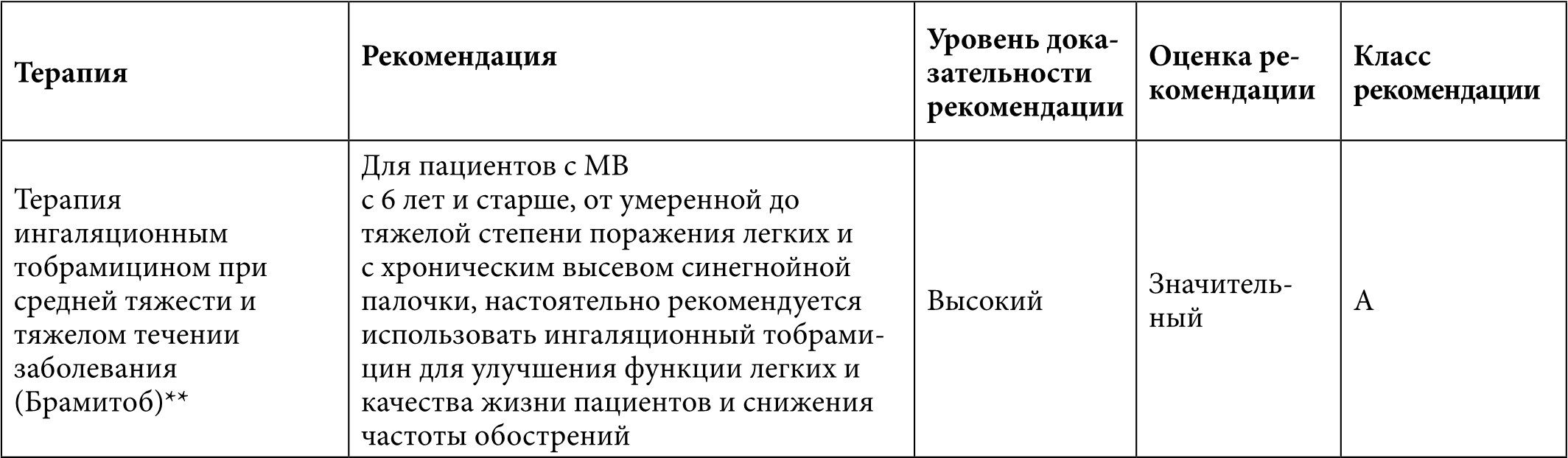
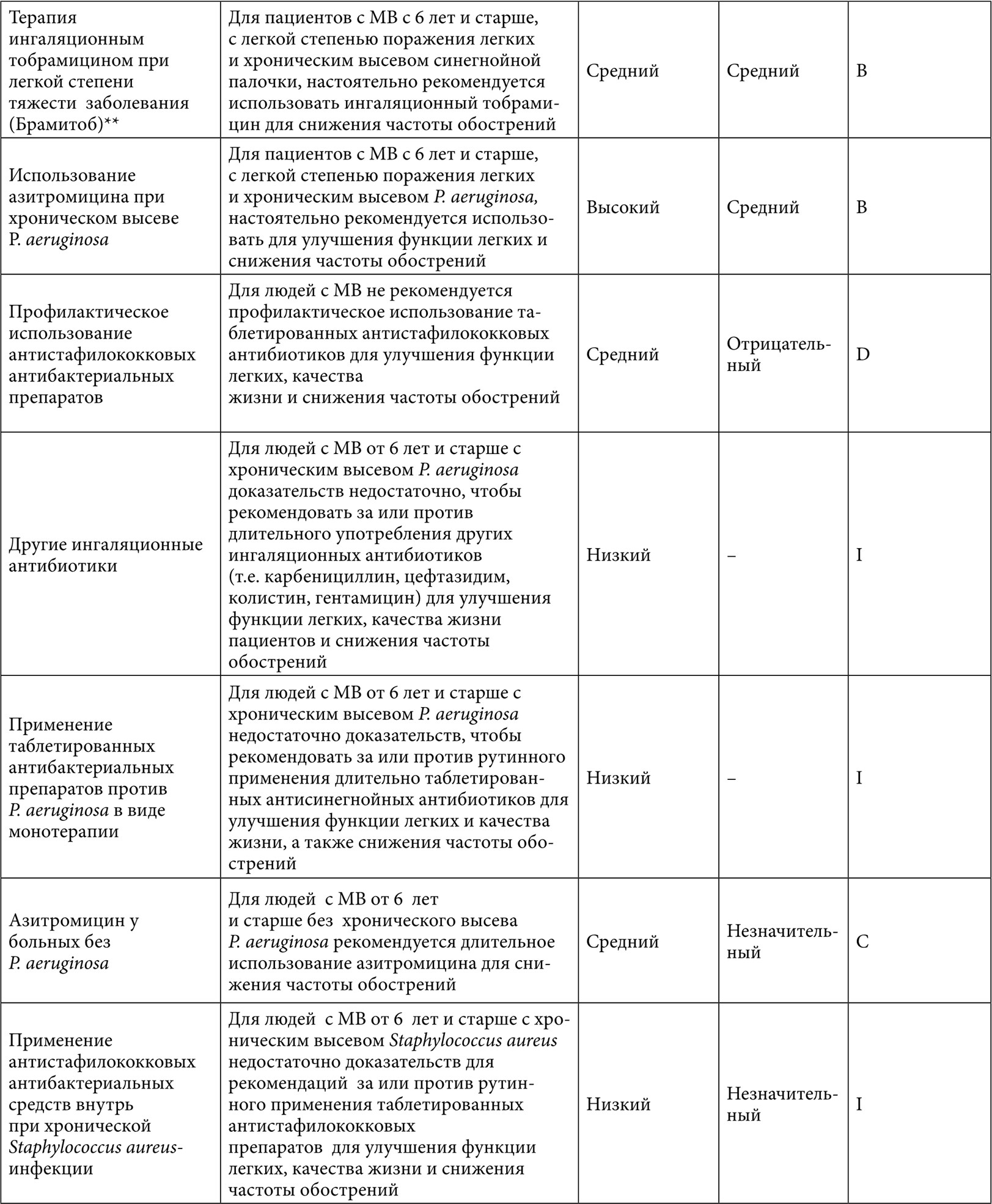
Примечание:
** Tяжесть заболевания легких определяется по ОФВ1 следующим образом: нормальная – 90% от должного; легкие нарушения – 70-89% от должного; умеренные нарушения – 40-69% и тяжелые нарушения – менее 40% от должного [12].
Литература
1. Капранов Н.И., Каширская Н.Ю. Муковисцидоз. М.: Медпрактика-М, 2014.
2. Tramper-Stranders G.A., van der Ent C.K., Molin S., et al. Initial Pseudomonas aeruginosa infection in patients with cystic fibrosis: characteristics of eradicated and persistent isolates. Clin. Microbiol. Infect. 2012; 18 (6): 567–74.
3. Ашерова И.К., Капранов Н.И. Муковисцидоз – медико-социальная проблема. М., Ярославль: Печатный дом, 2013.
4. Шагинян И.А., Капранов Н.И., Чернуха М.Ю. и др. Микробный пейзаж нижних дыхательных путей у различных возрастных групп детей, больных муковисцидозом. Журнал микробиологии, эпидемиологии и инфекционных болезней. 2009; 5: 15–20.
5. Guss A.M., Roeselers G., Newton I.L.G., et al. Phylogenetic and metabolic diversity of bacteria associated with cystic fibrosis. The ISME Journal. 2011; 5 (1): 20–9.
6. Hoiby N. Microbiology of lung infections in cystic fibrosis patients. Acta Paediat. Scand. 1982; 301 (Suppl.): 33–54.
7. Lahiri T., Waltz D.A. Preimmunization anti-pneumococcal antibody levels are protective in a majority of patients with cystic fibrosis. Pediatrics. 2001; 108 (4): 62.
8. Demco C.A., Stern R.C., Doershuk C.F. Stenotrophomonas maltophilia in cystic fibrosis: incidence and prevalence. Pediatr. Pulmonol. 1998; 25: S304–8.
9. Alan R., Smyth, Scott C. Bell, Snezana Bojcin, et al. Review. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. Journal of Cystic Fibrosis. 2014; 13: 23–42.
10. Красовский С.А., Никонова В.С., Каширская Н.Ю. и др. Клинико-генетическая, микробиологическая и функциональная характеристика больных муковисцидозом, проживающих в Москве и Московской области. Вопросы современной педиатрии. 2013; 12 (1): 24–30.
11. Cystic Fibrosis Foundation Patient Registry: 2005. Annual data report to the center directors. Bethesda, MD: Cystic Fibrosis Foundation, 2006.
12. Flume P.A., O’Sullivan B.P., Robinson K.A., et al. Cystic fibrosis pulmonary guidelines: chronic medications for maintenance of lung health. Am. J. Respir. Crit. Care Med. 2007; 176: 957–69.
13. Kosorok M.R., Zeng L., West S.E., et al. Acceleration of lung disease in children with cystic fibrosis after Pseudomonas aeruginosa acquisition. Pediatr. Pulmonol. 2001; 32: 277–87.
14. Dodge J.A., Lewis P.A., Stanton M., Wilsher J. Cystic fibrosis mortality and survival in the UK: 1947–2003. Eur. Respir. 2007; 29: 522–6.
15. Berezin E. Pharmacokinetics of antibiotics in cystic fibrosis patients with particular reference to the bronchopulmonary tree. Infection. 1987; 15: 288–94.
16. Prandota J. Clinical pharmacology of antibiotics and other drugs in cystic fibrosis. Drugs. 1988; 35: 542–78.
17. Vic P., Ategbo S., Turck D., et al. Eficacy, tolerance, and 763 antibiotic therapy against P. aeruginosa in CF pharmacokinetics of once daily tobramycin for Pseudomonas exacerbations in cystic fibrosis. Arch. Dis. Child. 1998; 78: 536–9.
18. Antibiotic Treatment for Cystic Fibrosis. Report of the UK Cystic Fibrosis Trust Antibiotic Group. London: UK Cystic Fibrosis Trust, 2009.
19. Flume P.A., Mogayzel P.J., Robinson K.A., et al. Cystic Fibrosis Pulmonary Guidelines: Treatment of Pulmonary Exacerbations. Am. J. Respir. Crit. Care Med. 2009; 180: 802–8.
20. Mogayzel P.J., Naureckas E.T., Robinson K.A., et al. Cystic Fibrosis Pulmonary Guidelines. Am. J. Respir. Crit. Care Med. 2013; 187: 680–9.
21. Lietman P.S. Pharmacokinetics of antimicrobial drugs in cystic fibrosis; β-lactam antibiotics. Chest. 1988; 94: 115–8.
22. Smith M.J., White L.O., Bowyer H., et al. Pharmacokinetics and sputum penetration of ciprofloxacin in patients with cystic fibrosis. Antimicrob. Agents Chemother. 1986; 30: 614–6.
23. Hunt B.E., Weber A., Berger A., et al. Macromolecular mechanisms of sputum inhibition of tobramycin activity. Antimicrob. Agents Chemother. 1995; 39: 34–9.
24. Levy J., Smith A.L., Koup J.R., et al. Disposition of tobramycin in patients with cystic fibrosis: a prospective controlled study. J. Pediatr. 1984; 105: 117–24.
25. Levy J. Antibiotic activity in sputum. J. Pediatr. 1986; 108: 841–6.
26. Ramphal R., Lhermitte M., Filliat M., Roussel P. The binding of anti-pseudomonal antibiotics to macromolecules from cystic fibrosis sputum. J. Antimicrob. Chemother. 1988; 22: 483–90.
27. Grimwood K., To M., Rabin H.R., Woods D.E. Inhibition of Pseudomonas aeruginosa exoenzyme expression by subinhibitory antibiotic concentrations. Antimicrob. Agents Chemother. 1989; 33: 41–7.
28. Shibl A. Effect of antibiotics on production of enzymes and toxins by microorganisms. Rev. Infect. Dis. 1983; 5: 865–75.
29. Dalhoff A., Doеring G. Interference of ciprofloxacin with the expression of pathogenicity factors of Pseudomonas aeruginosa. In: Adam D., Hahn H., Opferkuch W., eds. The Influence of Antibiotics on the Host-parasite Relationship II. Berlin: Springer, 1985: 246–55.
30. Regaard A.R., Bjuro K., Bukholm G., Berdal B.P. Pseudomonas aeruginosa virulence factors: modifications by subinhibitory concentrations of carbenicillin or gentamycin. Acta Path. Microbiol. Immunol. Scand. 1986; 94: 63–8.
31. Cantin A.M., Woods D.E. Protection by antibiotics against myeloperoxidase-dependent cytotoxicity to lung epithelial cells in vitro. J. Clin. Invest. 1993; 91: 38–45.
32. Barclay M.L., Begg E.J., Chambers S.T., et al. Adaptive resistance to tobramycin in Pseudomonas aeruginosa lung infection in cystic fibrosis. J. Antimicrob. Chemother. 1996; 37: 1155–64.
33. Mann H.J., Canafax D.M., Cipolle R.J., et al. Increased dosage requirements of tobramycin and gentamicin for treating Pseudomonas pneumonia in patients with cystic fibrosis. Pediatr. Pulmonol. 1985; 1: 238–43.
34. De Groot R., Hack B.D., Weber A., et al. Pharmacokinetics of ticarcillin in patients with cystic fibrosis: a controlled prospective study. Clin. Pharmacol. Ther. 1990; 47: 73–8.
35. De Groot R., Smith A.L. Antibiotic pharmacokinetics in cystic fibrosis. Differences and clinical significance. Clin. Pharmacokinet. 1987; 13: 228–53.
36. Horrevorts A.M, de Witte J., Degener J.E., et al. Tobramycin in patients with cystic fibrosis. Adjustment in dosing interval for effective treatment. Chest. 1987; 92: 844–8.
37. Stutman H.R., Shalit I., Marks M.I., et al. Pharmacokinetics of two dosage regimens of ciprofloxacin during a two-week therapeutic trial in patients with cystic fibrosis. Am. J. Med. 1987; 82: 142–5.
38. Prandota J. Drug disposition in cystic fibrosis: progress in understanding pathophysiology and pharmacokinetics. Pediatr. Infect. Dis. 1987; 6: 1111–26.
39. Szaff M., Hoiby N., Flensborg E.W. Frequent antibiotic therapy improves survival of cystic fibrosis patients with chronic Pseudomonas aeruginosa infection. Acta Paediat. Scand. 1983; 72: 651–7.
40. Lee T.W., Brownlee K.G., Conway S.P., et al. Evaluation of a new definition for chronic Pseudomonas aeruginosa infection in cystic fibrosis patients. J. Cyst. Fibros. 2003; 2: 29–34.
41. Proesmans M., Balinska-Miskiewicz W., Dupont L., et al. Evaluating the «Leeds criteria» for Pseudomonas aeruginosa infection in a cystic fibrosis centre. Eur. Respir. J. 2006; 27: 937–43.
42. Ratjen F., Doring G., NiKolaizik W.H. Effect of inhaled tobramycin on early Pseudomonas aeruginosa colonization in patients with cystic fibrosis. Lancet. 2001; 358 (9286): 983–4.
43. Mayer-Hamblett N., Kronmal R.A., Gibson R.L., et al. Initial Pseudomonas aeruginosa treatment failure is associated with exacerdations in cystic fibrosis. Pediatr. Pulmonol. 2012; 47 (2): 125–34.
44. Marchetti F., Giglio L., Candusso M., et al. Early antibiotic treatment of Pseudomonas aeruginosa colonization in cystic fibrosis: a critical review of the literature. Eur. J. Clin. Pharmacol. 2004; 60: 67–74.
45. Clinical Guidelines: Care of Children with Cystic Fibrosis. Royal Brompton Hospital, 2014. www.rbht. nhs.uk/childrencf (дата обращения: 10.06.2014).
46. Cystic Fibrosis in children and adults. The Leeds Method of Management. November 7, 2008, St. James’s University Hospital, UK.
47. Hodson M.E., Roberts C.M., Butland R.J., et al. Oral ciprofloxacin compared with conventional intravenous treatment Pseudomonas aeruginosa infection in adult with cystic fibrosis. Lancet. 1987; 1: 235–7.
48. Shalit I., Stutman H.R. Marks M.I., et al. Randomized study of two dosage regimens of ciprofloxacin for treating chronic bronchopulmonary infection in patients with cystic fibrosis. Am. J. Med. 1987; 82: 189–95.
49. Church D.A., Kanga J.F., Kuhn R.J., et al. Sequential ciprofloxacin therapy in pediatric cystic fibrosis: comparative study vs. Ceftazidime/tobramycin in the treatment of acute pulmonary exacerbations. The Cystic Fibrosis Study Group. Pediatr. Infect. Dis. J. 1997; 16: 97–105.
50. Schaad U.B., Wedgwood-Krucko J., Guenin K., et al. Antipseudomonal therapy in cystic fibrosis: aztreonam and amikacin versus ceftazidime and amikacin administered intravenously followed by oral ciprofloxacin. Eur. J. Clin. Microbiol. Infect. Dis. 1989; 8: 858–65.
51. Frederiksen B., Koch C., Hoiby N. Antibiotic treatment of initial colonization with Pseudomonas aeruginosa postpones chronic infection and prevents deterioration of pulmonary function in cystic fibrosis. Pediatr. Pulmonol. 1997; 23: 330–5.
52. Ramsey B.W., Pepe M.S., Quan J.M., et al. Intermittent administration of inhaled tobramycin in patients with cystic fibrosis. Cystic fibrosis Inhaled Tobramycin Study Group. N. Engl. J. Med. 1999; 340: 23–92.
53. Knowles M.R., Robinson J.M., Wood R.E., et al. Ion composition of airway surface liquid of patients with cystic fibrosis as compared with normal and disease control subjects. J. Clin. Invest. 1997; 100: 2588–95.
54. Konstan M.W., Flume P.A., Kappler M., et al. Safety, eficacy and convenience of tobramycin inhalation powder in cystic fibrosis patients: The EAGER trial. Journal of Cystic Fibrosis. 2011; 10 (1): 54–61.
55. Littlewood J.M., Miller M.G., Ghoneim A.T., Ramsden C.H. Nebulised colomycin for early Pseudomonas colonization in cystic fibrosis. Lancet. 1985; 1: 865.
56. MacLusky I., Gold R., Corey M., Levison H. Long-term effects of inhaled tobramycin in patients with cystic fibrosis colonized with Pseudomonas aeruginosa. Pediatr. Pulmonol. 1989; 7: 42–8.
57. Valerius N.H., Koch C., Hoiby N. Prevention of chronic Pseudomonas aeruginosa Antibiotic treatment of initial colonization with postpones infection and prevent deterioration of pulmonary function in cystic fibrosis by early treatment. Lancet. 1991; 338 (8769): 725–6.
58. Ryan G., Singh M.K.D. Inhaled antibiotics for longterm therapy in cystic fibrosis. Cochrane Database Syst Rev. 2011; Issue 3. Art. No.: CD001021. DоI: 10.1002/14651858. CD001021.pub2.
59. Hoiby N. Pseudomonas in Cystic Fibrosis: past, present, future. The Fourth Joseph Levy Lecture. Cystic Fibrosis Trust, Berlin, June 1998: 1–25.
60. Taccetti G., Bianchini E., Cariani L., et al. Early antibiotic treatment for Pseudomonas aeruginosae radicationin patients with cystic fibrosis: a randomized multicentre study comparing two different protocols. Thorax. 2012; 67 (10): 853–59.
61. Hansen C.R., Pressler T., Hoiby N. Early aggressive eradication therapy for interrmittent Pseudomonas aeruginosa colonizationin cystic fibrosis patients: 15 years experience. J. Cyst. Fibros. 2008; 7 (6): 523–30.
62. Wiesemann H.G., Steinkamp G., Ratjen F., et al. Placebocontrolled, double-blind, randomized study of aerolized tobramycin for early treatment of Pseudomonas aeruginosa infection in cystic fibrosis. Pediatr. Pulmonol. 1998; 25: 88–92.
63. Gibson R.L., Emerson J., McNamara S., et al. Significant microbiological effect of inhaled tobramycin in young children with cystic fibrosis. Am. J. Respir. Crit. Care Med. 2003; 167 (6): 841–9.
64. Langton-Hewer S.C., Smyth A.R. Antibiotic strategies for eradicating Pseudomonas aeruginosa in people with cystic fibrosis. Cochrane Database Syst Rev. 2006: Issue 4. Art. No.: CD004197 (updated 2010) DOI:10.1002/14651858.CD004197. pub3.
65. Treggiari M.M., Retsch-Bogart G., Mayer-Hamblett N., et al. Comparative eficacy and safety of 4 randomized regimens to treat early Pseudomonas aeruginosa infection in children with cystic fibrosis. Arch. Pediatr. Adolesc. Med. 2011; 165: 847–56.
66. Gibson R.L., Emerson J., Mayer-Hamblett N., et al. Duration of treatment effect after tobramycin solution for inhalation in young children with cystic fibrosis. Pediatr. Pulmonol. 2007; 42: 610–23.
67. Proesmans M., Vermeulen F., Boulanger L., et al. Comparison of two treatment regimens for eradication of P. аeruginosa infection in children with cystic fibrosis. J. Cyst. Fibros. 2013; 12 (1): 29–34.
68. Rosenfeld M., Gibson R., McNamara S., et al. Serum and lower respiratory tract drug concentrations produced by tobramycin for inhalation in young children with cystic fibrosis J. Pediatr. 2001; 139: 572–7.
69. Marchetti F., Giglio L., Candusso M., et al. Early antibiotic treatment of Рseudomonas aeruginosa colonization in cystic fibrosis: a critical review of the literature. European Journal of Clinical Pharmacology. 2004; 60 (2): 67–4.
70. Sordе R., Pahissa A., Rello J. Management of refractory Pseudomonas aeruginosa infection in cystic fibrosis. Infect. Drug Resistance. 2011; 4: 31–41.
71. Koch C., Hоiby N. Antibiotic treatment of initial colonization with Pseudomonas aeruginosa postpones chronic infection and prevents deterioration of pulmonary function in cystic fibrosis. Pediatr. Pulmonol. 1997; 23: 330–5.
72. Jensen T., Pedersen S.S., Garne S., et al. Colistin inhalation therapy in cystic fibrosis patients with chronic Pseudomonas aeruginosa lung infection. J. Antimicrob. Chemother. 1987; 19: 831–38.
73. Jensen T., Pedersen S.S., Hoiby N., Koch C. Eficacy of oral fluoroquinolones versus conventional intravenous antipseudomonal chemotherapy in treatment of cystic fibrosis. Eur. J. Clin. Microbiol. 1987; 6: 618–22.
74. Jensen T., Pederson S.S., Hoiby N., et al. Use of antibiotics in cystic fibrosis: the Danish approach. Antibiot. Chemother. 1989; 42: 237–46.
75. Amelina E., Cherniak A., Krasovsky S. Burkholderia cepacia infection in adult cystic fibrosis patients: its impact on lung function and survival. Abstracts 20th ERS Annual Congress. Spain, Barcelona, September 18–22, 2010. Eur. Respir. J. 2010; 36 (Suppl. 54): 885s: 4807.
76. Sousa S.A., Ramos C.G., Leitаo J.H. Burkholderia cepacia сomplex: Emerging Multihost Pathogens Equipped with a Wide Range of Virulence Factors and Determinants. Int. J. Microbiol. 2011; 2011. Pii: 607575. Doi: 10.1155/2011/607575. Epub 2010 Aug 3.
77. Воронина О.Л., Чернуха М.Ю., Шагинян И.А. и др. Характеристика генотипов штаммов Burkholderia cepacia complex, выделенных от больных в стационарах Российской Федерации. Молекулярная генетика. 2013; 2: 22–30.
78. Etherington C., Peckham D.G., Conway S.P., et al. Burkholderia cepacia complex infection in adults with cystic fibrosis – is early eradication possible? J. Cyst. Fibrosis. 2003; 2: 220–1.
79. Horsley A., Webb K., Bright-Thomas R., et al. Can early Burkholderia cepacia complex infection in cystic fibrosis be eradicated with antibiotic therapy? Front. Cell. Infect. Microbiol. 2011; 1: 18.
80. Dоring G., Flume P., Heijerman H., Elborn J.S. Treatment of lung infection in patients with cystic fibrosis: Current and future strategies. Journal of Cystic Fibrosis. 2012; 11: 461–79.



