 Полная версия
Полная версияСмысл, Цель и Суть жизни человека

Типы снежинок
С ростом давления температура кипения воды растёт:[119]
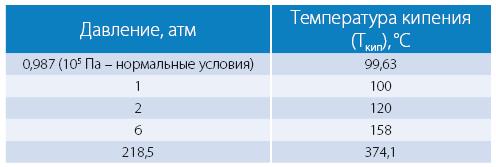
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды – падает. При температуре 374 °C (647 К) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях – пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Также, вода может существовать в виде двух разных жидкостей («вторая вода» возникает при температуре около -70 °C и давлении в тысячи атмосфер), которые при определённых условиях даже не смешиваются друг с другом; гипотеза, что вода может существовать в двух различных жидких состояниях, была предложена примерно 30 лет назад на основе результатов компьютерного моделирования и экспериментально проверена только в 2020 г.[120]
Удельная теплоёмкость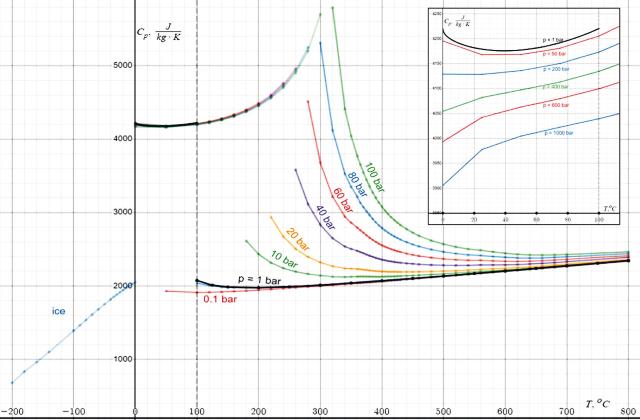
Теплоёмкость льда, воды, и водяного пара при различных давлениях

Эти данные можно аппроксимировать уравнением
Cp(t) = 4219,7 + 0,009356 ∙ t2 – 9,2788 ∙ √t {0 ≤ t ≤ 100 °C}[121].
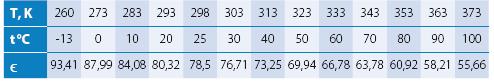
Диэлектрическая проницаемость водыСтатическая (для постоянного электростатического поля) диэлектрическая проницаемость воды при разной абсолютной температуре при давлении 1 бар в диапазоне температур -13… 100 °C выражается эмпирической формулой[122]
ϵ (T) = 253,0390655 – 0,810393675889 · T + 0,000753946922643 · T2;
P = 1 bar; 260 K ≤ T ≤ 373,15 K.
Результаты вычислений по этой формуле[123]:
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег – около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
• лёгкая вода (основная составляющая привычной людям воды) Н2О;
• тяжёлая вода (дейтериевая) D2O;
• сверхтяжёлая вода (тритиевая) Т2О;
• тритий-дейтериевая вода TDO;
• тритий-протиевая вода ТНО;
• дейтерий-протиевая вода DHO.
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий – самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а.е.м., тритий – самый тяжёлый, атомная масса 3,0160492777 а.е.м. В воде из-под крана тяжелокислородной воды (Н2О17 и Н2О18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[124].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[125].
По стабильным изотопам кислорода 16О, 17О и 18О существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Воду иногда рассматривают как амфолит – и кислоту и основание одновременно (катион Н+ анион ОН-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), рКа = р (1,8-10-16) ~ 15,74. Вода – химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и, в частности, гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
• В ходе реакций -
2Н2О2 → 2Н2О + О2↑
NaHCO3 + СН3СООН → CH3COONa + Н2О + СО2↑
2СН3СООН + СаСО3 → Са(СН3СОО)2 + Н2О + СО2↑
• В ходе реакций нейтрализации -
H2SO4 + 2КОН → K2SO4 + 2Н2О
HNO3 + NH4OH → NH4NO3 + Н2О
2СН3СООН + Ва(ОН)2 Ва(СН3СОО)2 + 2Н2О
• Восстановлением водородомаоксидов металлов -
CuO + Н2 → Си + Н2О
Под воздействием очень высоких температур или электрического тока (при электролизе)[126], а также под воздействием ионизирующего излучения, как установил в 1902 году[127] Фридрих Гизель при исследовании водного раствора бромида радия[128], вода разлагается на молекулярный кислород и молекулярный водород:
2Н2О → 2Н21 + О2↑
Вода реагирует при комнатной температуре:
• с активными металлами (натрий, калий, кальций, барий и др.)
2Н2О + 2Na → 2NaOH + Н2↑
• со фтором и межгалоидными соединениями
2Н2О + 2F2 → 4HF + О2
Н2О + F2 HF + HOF (при низких температурах)
3Н2О + 2IF5 → 5HF + НЮ3
9Н2О + 5BrF3 → 15HF + Вг2 – 3НВгО3
• с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
Al2S3 + 6Н2О → 2Al(ОН)3↓ + 3H2S↑
• с ангидридами и галогенангидридами карбоновых и неорганических кислот;
• с активными металлорганическими соединениями (ди-этилцинк, реактивы Гриньяра, метилнатрий и т. д.);
• с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.);
• со многими солями, образуя гидраты;
• с боранами, силанами;
• с кетенами, недоокисью углерода;
• с фторидами благородных газов.
Вода реагирует при нагревании:
4Н2О + 3Fe → Fe3O4 + 4Н2
• с железом, магнием;
• с углём, метаном;
• с некоторыми алкилгалогенидами.
Вода реагирует в присутствии катализатора:
Н2О + С ⇄ CO + H2
• с амидами, эфирами карбоновых кислот;
• с ацетиленом и другими алкинами;
• с алкенами;
• с нитрилами.
Волновая функция основного состояния водыВ валентном приближении электронная конфигурация молекулы Н2О в основном состоянии: (1a1)1 (1b2)2 (1b1)2 (2b2)0 (3a1)0.
Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО φi) – по два электрона на каждой МО φi, один со спином α, другой со спином β, или 8 спин-орбиталей ψ.
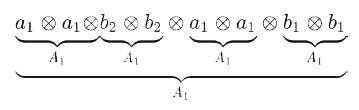
Волновая функция молекулы ψ, представленная единственным детерминантом Слэтера Φ, имеет вид:

Симметрия этой волновой функции определяется прямым произведением НП, по которым преобразуются все занятые спин-орбитали:

Принимая во внимание, что прямое произведение невырожденного НП самого на себя является полносимметричным НП и прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем:
Виды
Вода на Земле может существовать в трёх основных состояниях:
• твёрдом;
• жидком;
• газообразном.
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
• водяной пар и облака в небе;
• морская вода и айсберги;
• ледники и реки на поверхности земли;
• водоносные слои в земле.
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды как источника жизни, её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения
По содержанию катионов кальция и магния:
• мягкая вода;
• жёсткая вода.
По изотопам водорода в молекуле:
• лёгкая вода (по составу почти соответствует обычной);
• тяжёлая вода (дейтериевая);
• сверхтяжёлая вода (тритиевая).
Другие виды:
• пресная вода;
• дождевая вода;
• морская вода;
• подземные воды;
• минеральная вода;
• солоноватая вода;
• питьевая вода и водопроводная вода;
• дистиллированная вода и деионизированная вода;
• сточные воды;
• ливневая вода или поверхностные воды;
• апирогенная вода;
• поливода;
• структурированная вода;
• талая вода;
• мёртвая вода и живая вода – виды воды со сказочными свойствами.
Вода, входящая в состав другого вещества и связанная с ним физическими связями, называется влагой. В зависимости от вида связи, выделяют:
• сорбционную, капиллярную и осмотическую влагу в твёрдых веществах;
• растворённую и эмульсионную влагу в жидкостях;
• водяной пар или туман в газах.
Вещество, содержащее влагу, называют влажным веществом. Влажное вещество, не способное более сорбировать (поглощать) влагу, – насыщенное влагой вещество.
Вещество, в котором содержание влаги пренебрежимо мало при данном конкретном применении, называют сухим веществом. Гипотетическое вещество, совершенно не содержащее влагу, – абсолютно сухое вещество. Сухое вещество, составляющее основу данного влажного вещества, называют сухой частью влажного вещества.
Смесь газа с водяным паром носит название влажный газ (парогазовая смесь – устаревшее название).
В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая – криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, ледники – 1,81 %, подземные воды – около 0,63 %, реки и озёра – 0,009 %, материковые солёные воды – 0,007 %, атмосфера – 0,001 %[129].
Вода за пределами Земли
Вода – чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[130].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[131],[132] Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[133], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[134], Венеры (0,002 %)[135], Луны[136], Марса (0,03 %)[137], Юпитера (0,0004 %)[138], Европы[139], Сатурна, Урана (следы)[140] и Нептуна[141] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3–4 % в тропиках и до 2-10-5% в Антарктиде.
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b[142], HD 209458 Ь[143] и GJ1214 Ь[144].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет – наиболее вероятно, на Европе – спутнике Юпитера.
Биологическая роль
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время – достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание – считается, что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
В земледелии
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию.
Для питья и приготовления пищи
Живое человеческое тело содержит от 50 % до 75 % воды[145], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.

Бокал чистой питьевой воды

Полный стакан с водой
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[146].[147]
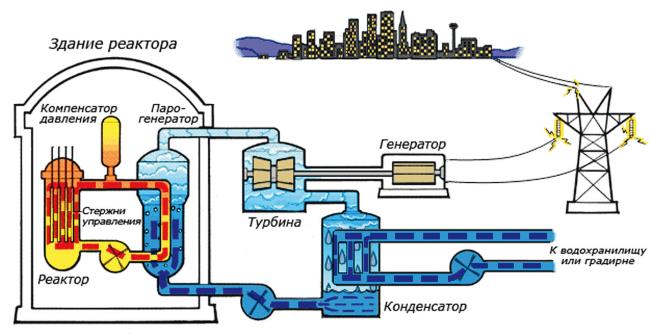
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)
В спорте
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
Для смазки
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[148].
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В 2010-е годы было установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад[149].
Гидрология
Гидрология – наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных водах.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[150].
Гидрогеология
Гидрогеолoгия (от др. – греч. ὕδωρ «водность» + геология) – наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой.
В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования.

Гидроабразивная резка
Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Литература
• Яковлев В. А. Вода // Энциклопедический словарь Брокгауза и Ефрона: в 86 т. (82 т. и 4 доп.). – СПб., 1890–1907.
• Лосев К. С. Вода. – Л.: Гидрометеоиздат, 1989. – 272 с. -113 000 экз. – ISBN 5-286-00161-0.
• Гидробионты в самоочищении вод и биогенной миграции элементов. – М.: МАКС-Пресс. 2008. – 200 с. – ISBN 978-5-317-02625-7.
• О некоторых вопросах поддержания качества воды и её самоочищения // Водные ресурсы. – 2005. – Т. 32. -№ 3. – С. 337–347.
• Андреев В. Г. Влияние протонного обменного взаимодействия на строение молекулы воды и прочность водородной связи // Материалы V Международной конференции «Актуальные проблемы науки в России». -2008.-Т.З.-С. 58–62.
• Арабаджи В. И. Загадки простой воды: в мире воды и льда. – М.: Знание, 1973.-96 с.
• Кульский Л. А., Даль В. В., Ленчина Л. Г. Вода знакомая и загадочная. – Киев: Радянська школа, 1982. – 120 с.
• Мельник А. Г. Вода в христианских сакральных практиках Древней Руси конца X–XVII веков//Святая вода в иеротопии и иконографии христианского мира ⁄ ред. – сост. А. М. Лидов. – М.: ООО «Феория», 2017. – С. 496–520. -ISBN 978-5-91796-061-6.
• Рекомендации по межгосударственной стандартизации РМГ 75-2014. Государственная система обеспечения единства измерений. Измерения влажности веществ. Термины и определения. – М.: Стандартинформ, 2015. -IV+ 16с.
• Encrenaz, Therese. ISO observations of the giant planets and Titan: what have we learnt? (англ.) // Planetary and Space Science: journal. – 2003. – February (vol. 51,
no. 2). – P. 89–103. – doi: 10.1016/50032-0633(02)00145-9. -Bibcode: 2003P&SS…51…89E.
Приложение 14
Дигидрогена монооксид (научный юмор)
Дигидрогена монооксид (от лат. di – два, hydrogenium – водород, mono – один, oxygenium – кислород) – научная шутка, мистификация, которая использует незнакомое широкой публике название воды («дигидрогена монооксид») и описание её негативных для человека свойств в попытке убедить общественность в необходимости тщательной регуляции или даже полного запрета на использование этого вещества. Шутка предназначена для иллюстрации того, каким образом отсутствие школьных знаний и предвзятый анализ может привести к панике[151].
История
Популярный вариант шутки придумали студенты Калифорнийского университета в Санта-Крузе Эрик Лехнер, Ларс Норпчен и Мэтью Кауфман в 1990 году, распространив в кампусе листовки, предупреждавшие о загрязнении водопроводных систем опасным веществом – монооксидом дигидрогена[152].[153] Мысль возникла у Мэтью по аналогии с предупреждением о «гидроксиде водорода», опубликованном в мичиганской газете «Дюранд Экспресс», после чего трое приятелей решили придумать термин, который «звучал бы ещё опаснее». Эрик напечатал предупреждение на компьютере, после чего листовка была размножена на копировальном аппарате.
В 1994 году Крейг Джексон создал веб-страницу «Объединение за запрет DHMO»[154].
В 1997 году Натан Зонер, 14-летний ученик школы Игл-Рок в городе Айдахо-Фолс, штат Айдахо, собрал 43 голоса за запрещение химиката, опросив 50 одноклассников. За своё исследование, озаглавленное «Насколько мы легковерны?», Зонер получил первую премию на научной ярмарке Айдахо-Фолс[155]. В знак признания его эксперимента журналист Дэвид Мюррей (англ. David Murray) придумал термин «Зонеризм» (англ. Zohnerism), означающий «использование факта, которое приводит к ложным выводам публику, не сведущую в науке и математике».
1 апреля 1998 года член австралийского парламента объявил о начале кампании по запрету дигидрогена монооксида на международном уровне[156].
Предупреждение на веб-сайте
Первое упоминание на веб-страницах было приписано «Pittsburgh Post-Gazette» «Объединению по запрещению дигидрогена монооксида»[157].[158] – вымышленной организации, придуманной Крэйгом Джексоном. Предупреждение (в котором все утверждения соответствуют действительности) выглядело так [159]:
Недавно исследователи открыли факт загрязнения наших водопроводных систем опасным химикатом. Этот химикат бесцветный, безвкусный и не имеет запаха. Он убивает бесчисленное множество людей каждый год. Правительство не предприняло никаких попыток регулирования этого опасного заражения. Данный химикат называется «дигидрогена монооксид» (Dihydrogen monoxide).



