
Полная версия:
Боль в пояснице
К чему я веду. Ни врач, ни реабилитолог, физически не в состоянии постоянно следить за «накачкой в систему» пациента нужного объема анаболических миокинов, противовоспалительных цитокинов и ростовых факторов, которые принимают участие в репарации/регенерации поврежденной ткани. Чисто гипотетически над пациентом можно поставить реабилитолога с дрыном или нагайкой и, таким образом, «контролировать» и «стимулировать» процесс на протяжении полугода – года. Но это уже будет из разряда «БДСМ – реабилитации», которую потянуть финансово смогут не все пациенты. Так что в большинстве случаев пациент предоставлен сам себе и лично отвечает за выполнение рекомендаций по лечению и реабилитации. Перекладывание ответственности с «больной головы на здоровую» – практика широко распространенная. С точки зрения пациента в неудаче лечения всегда виноват или врач, или реабилитолог. Пациент поначалу что-то делал, у него где-то заболело, он расстроился и бросил это «гиблое дело». Купил в аптеке нестероидные и вроде немного стало легче…
Поскольку действие многих миокинов хорошо изучено и описано, фармакологическая промышленность быстро подсуетилась и наладила выпуск и продажу многих миокинов прямо баночной расфасовкой. Они это называют «Exercise Mimicking Drugs», то есть препараты, которые имитируют действие физических упражнений. В легенде это звучит красиво: для лечения возрастной саркопении, кахексии и прочее. По факту, большинство «продукции» поедается бодибилдерами и озабоченными собственным внешним видом и здоровьем.
Дегенеративная болезнь диска
Переходим к рассмотрению механизмов самой распространенной причины хронических болей в пояснице – дегенеративной болезни диска. Данное поражение позвоночника также известно как «межпозвонковый остеохондроз», «остеохондроз», «остеохондроз позвоночника», «дискоз», «активная дископатия», «остеоартрит позвоночника», «дискогенная боль».
Немного анатомии. Диск представляет собой диартроз (полусустав) – сочленение между двумя костями – позвонками. Комплект из двух позвонков и соединяющий их диск называется позвоночный двигательный сегмент (ПДС).
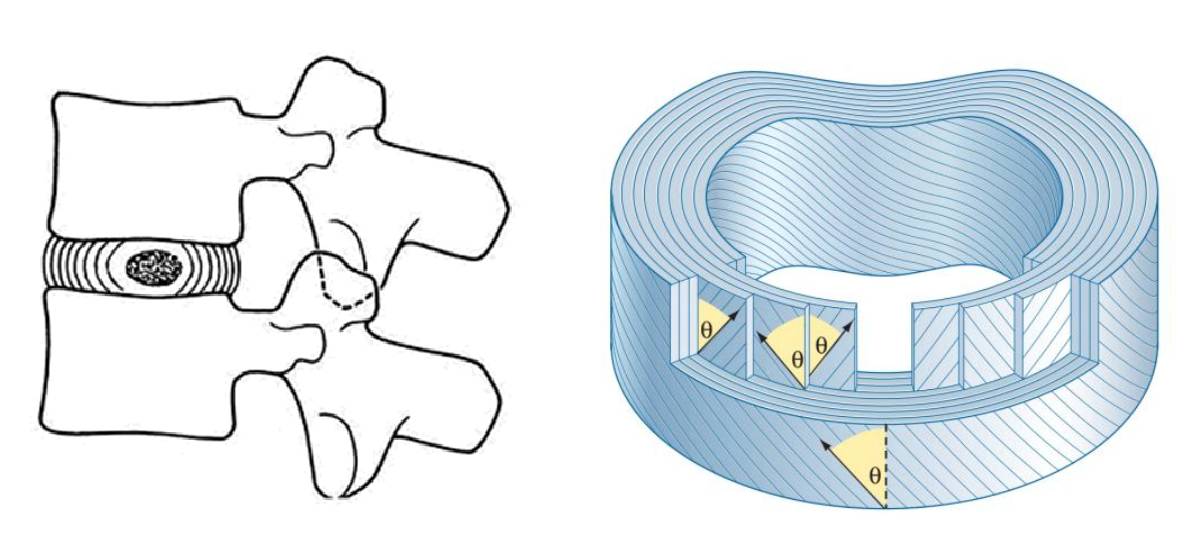
Позвоночно-двигательный сегмент и архитектура фиброзного кольца (Bogduk, 1997)
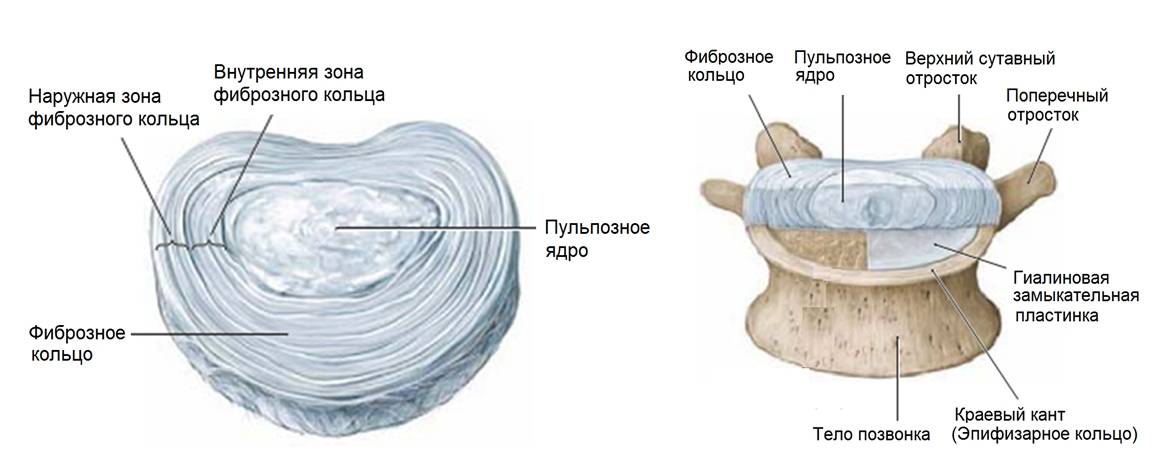
Позвоночно-двигательный сегмент и диск (Netter)
Строение и метаболизм диска современного человека имеет особенность, отличающую его от дисков млекопитающих, передвигающихся на четвереньках. В пульпозном комплексе у взрослого человека отсутствуют клетки нотохорды, синтезирующие значительное количество протеогликанов, структурных белков, поддерживающих высокое осмотическое давление в диске. К 4 – 10 годам у человека они замещаются хондроцитоподобными клетками, что значительно изменяет метаболизм и физические свойства диска. Часть хондроцитоподобных клеток фенотипически сходны с клетками нотохорды (вероятно, являются их производными) и способны синтезировать больше структурных белков, чем обычная зрелая клетка пульпозного комплекса диска. Чем выше соотношение нотохордоподобных клеток по отношению к хондроцитоподобным, тем выше способность синтеза структурных белков и тем «живуч» межпозвонковый диск. Переход к прямохождению привел к необходимости смещения амортизирующей части диска ближе к оси вектора гравитации с целью более равномерного распределения компрессионной нагрузки и повышения демпфирующих свойств. Если у передвигающихся на 4 конечностях млекопитающих буферный пульпозный комплекс располагается по центру диска, то у человека он смещен назад в поясничной и шейной области и вперед в грудной.
Таким образом, соотношение фиброзного кольца спереди и сзади 2/1. Бывает даже 3/1. Слабость задней стенки можно рассматривать как предрасполагающий фактор к раннему развитию дистрофии задней части диска и грыжеобразованию.
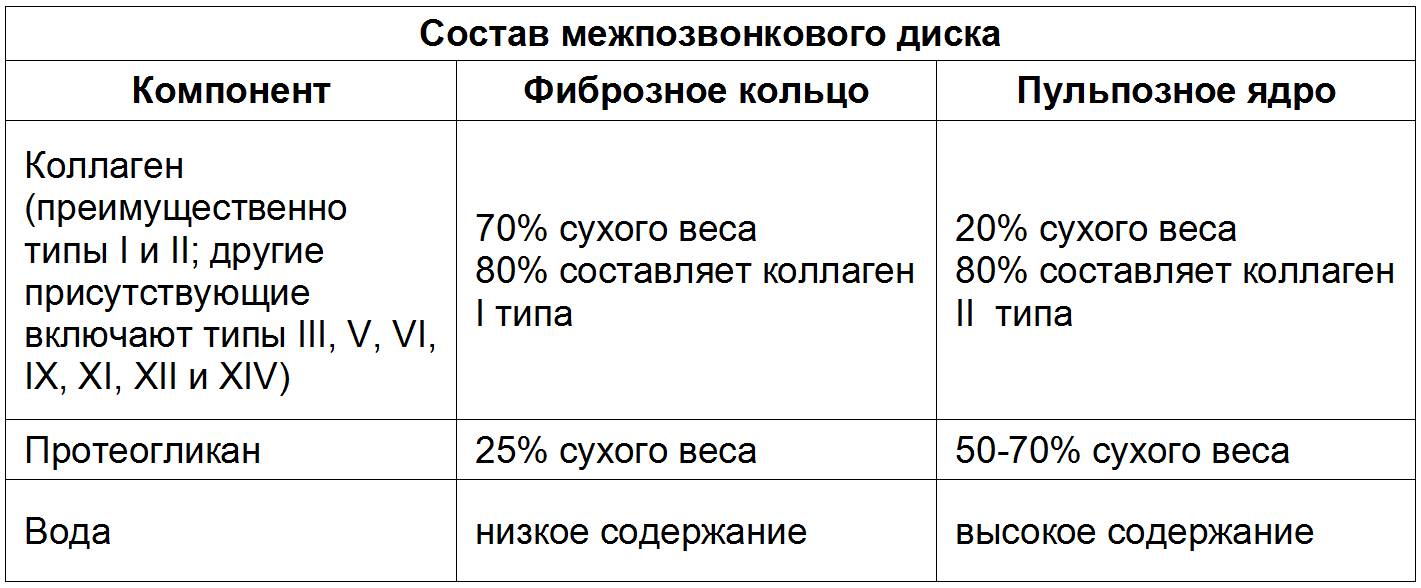
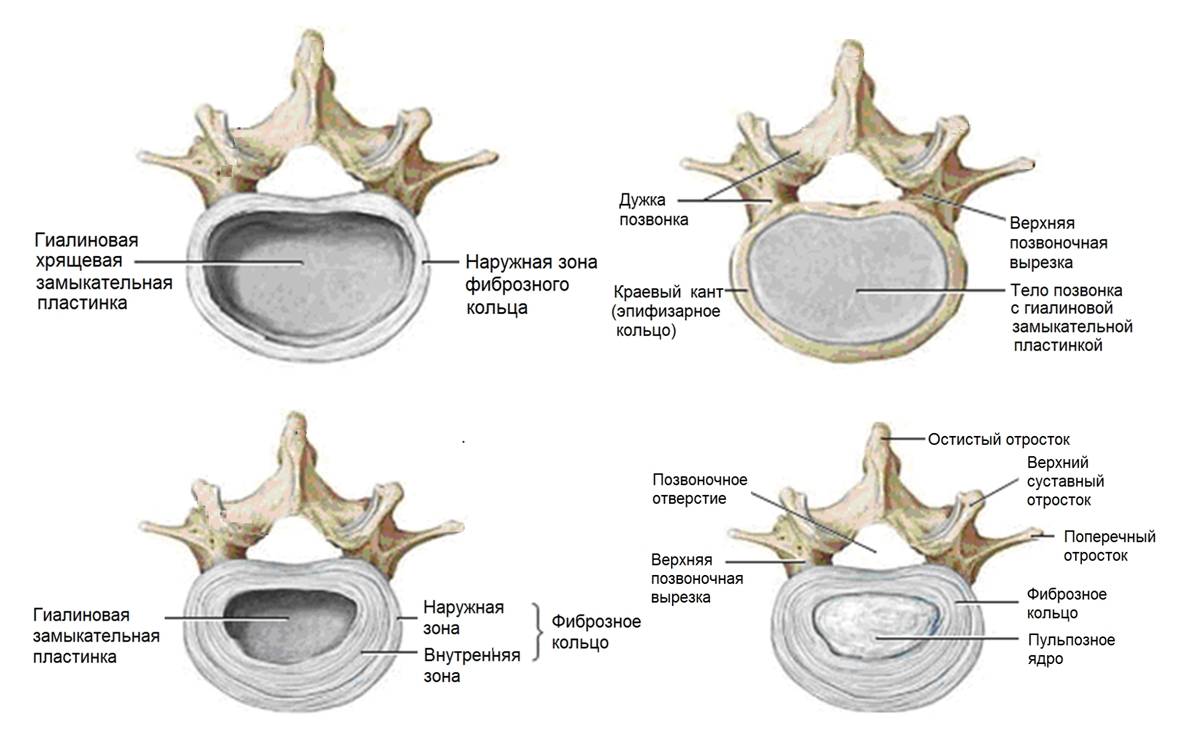
Анатомически диск состоит из трех основных составляющих: фиброзного кольца, пульпозного комплекса и верхней и нижней замыкательных пластинок.
Функционально фиброзное кольцо состоит из двух частей: собственно внутреннее кольцо, являющееся стенкой амортизирующей капсулы (с гелеподобным содержимым) и наружный футляр – плотная оболочка, удерживающая амортизирующую капсулу на месте (Анатомия по Неттеру).
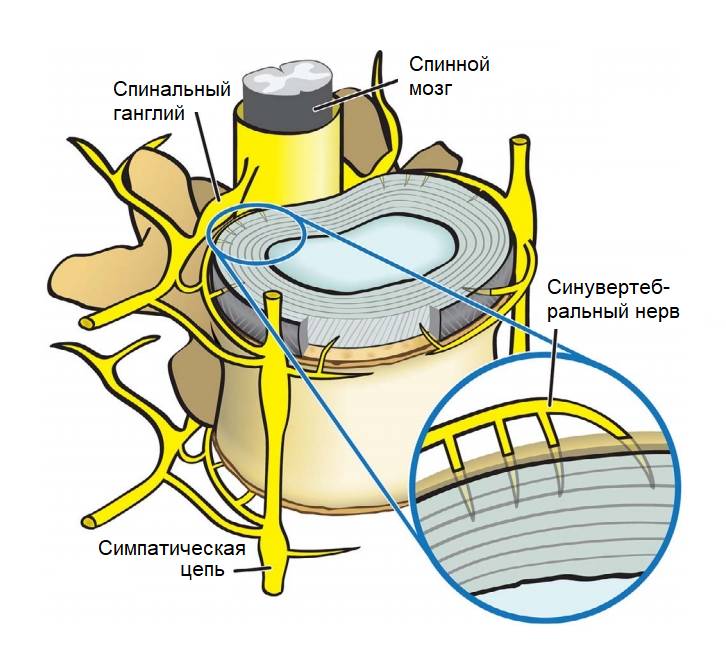
Иннервация фиброзного кольца диска (Pinheiro-Franco, Bonassar et al.)
Наружное кольцо (аналог капсулы сустава), жестко сращено шарпеевыми волокнами с костным краевым кантом позвонков – лимбусом. Основная функция – удержание амортизирующего дика (капсулы с гелем) на месте и противодействие тангенциальным, тракционным, сгибающим/разгибающим и ротационным нагрузкам.
Наружные слои (ламели) состоят из строго упорядоченных волокон плотного коллагена I типа, которые вырабатываются клетками фибробластами. Каждый слой имеет свое отличное от соседних направление волокон. Питание наружных слоев фиброзного кольца осуществляется через капилляры близлежащих сосудов. Задняя и боковые части наружной части кольца хорошо иннервированы чувствительными веточками синувертебрального нерва. Передняя часть – симпатическими волокнами. Глубина иннервации может достигать 3,5 мм. Боковые части диска содержат группу различных механорецепторов, участвующих в моторном контроле через реализацию миотонических рефлексов на свою сегментарную группу мышц и паравертебральные мышцы региона.
В здоровом диске между ламелями (слоями кольца) присутствует сеть волокон коллагена II типа с включением версикана и аггрекана, белков, удерживающих воду. Данная «прослойка» выполняет функцию смазки и позволяет ламелям скользить относительно друг друга при движениях. Такое независимое «скольжение» ламелей позволяет диску «мягкую» деформацию и предотвращает появление зон износа в волокнах наружных слоев. Для возврата ламелей в исходное положение предусмотрен механизм возврата к первоначальной форме. Диск прошит насквозь нитями эластина и коллагена II типа, соединяющие ламели вместе своеобразными «мостиками».
Внутреннее фиброзное кольцо представляет собой стенку амортизирующей капсулы, которая сращена с хрящевыми замыкательными пластинками, прилегающими к позвонкам.
Амортизирующая капсула – главная функциональная часть диска, которая выполняет основную задачу по распределению компрессионных и гашению ударных (при беге, прыжках) нагрузок на тела позвонков.
Капсула состоит из трех элементов:
Снизу и сверху – крыша и дно состоят из мембран – замыкательных пластин.
Замыкательные пластины представляют собой тонкие пластины из гиалинового хряща с системой трубочек и каналов, по которым питательные вещества поступают внутрь капсулы и через которые выводятся клеточные продукты жизнедеятельности и обмена. Пластины выполняют функцию мембраны-фильтра, которая позволяет проникать в полость капсулы только питательным веществам с низкой молекулярной массой.
Внешний слой замыкательной пластины, соприкасающийся непосредственно с костью, более плотный, с сетью запустевших каналов от капилляров, когда-то запитывавших диск в раннем возрасте. Во взрослом возрасте в замыкательной пластине могут находиться единичные капилляры, проникающие в пластину из костного мозга тела позвонка. Волокна замыкательных пластин строго упорядочены по направлению, плотно переплетаются с волокнами внутренних ламелей фиброзного кольца и способствуют их удержанию на своем месте при растяжении диска или при скручиваниях. Соотношение протеогликанов к коллагену 2 к 1, тогда как в пульпозном ядре – 27 к 1.
Основная клетка замыкательных пластин – хондроциты, которые вырабатывают коллаген II типа и аггрекан. Во взрослом возрасте замыкательная пластинка является «донором» хондроцитоподобных клеток для пульпозного комплекса. После смерти (апоптоза) клеток нотохорды в юношеском возрасте хондроциты мигрируют в пульпозный комплекс и сами начинают вырабатывать структурные белки протеогликаны, поддерживающие гомеостаз диска.
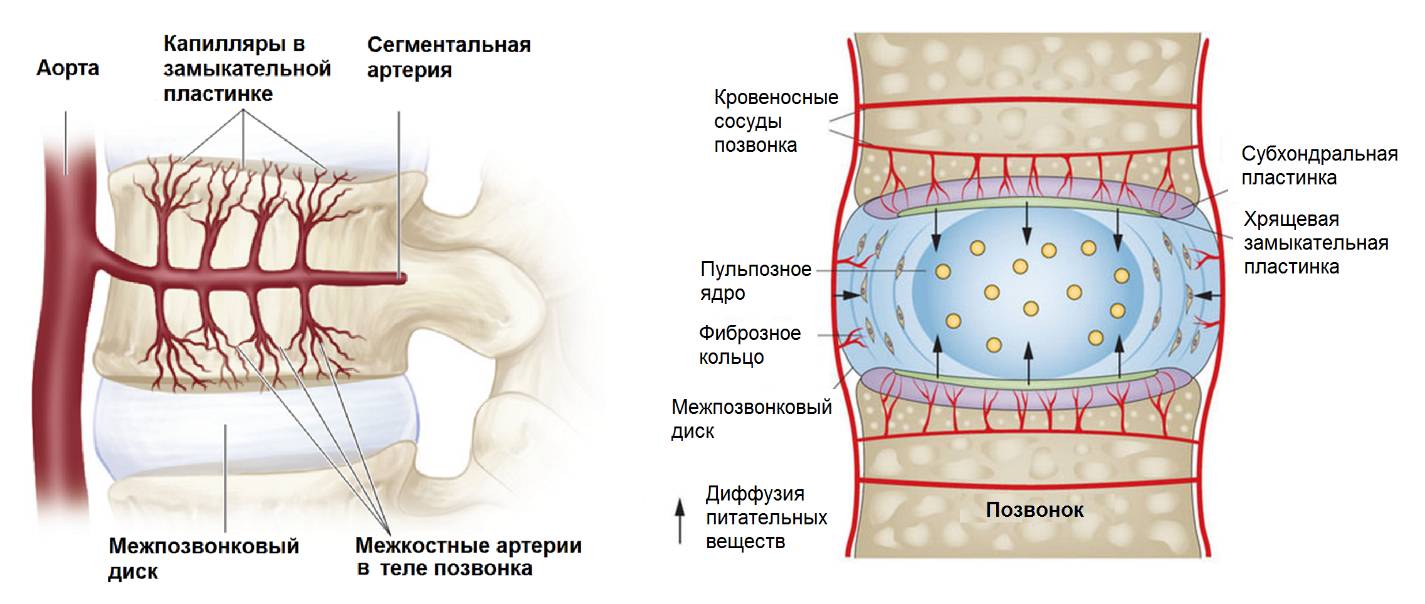
Капилляры, запитывающие замыкательные пластинки (Raj, 2008)
Стенки капсулы пульпозного комплекса также выполнены из листов-ламелей, но здесь прослеживается градиент коллагенового состава ламелей. Чем ближе к периферии кольца, тем больше коллагена I типа, чем ближе к пульпозному комплексу – больше коллагена II типа. Строение внутренних ламелей от более наружных отличается хаотичным расположением волокон, рыхлостью и беспорядочностью. В задней части внутреннего кольца до 40% ламелей могут быть не замкнуты и анатомически представлять собой «полукольца» или по форме напоминать «полумесяц». Подобная «рыхлость» задней части кольца также является предрасполагающим фактором к грыжеобразованию.
В молодом возрасте (до 10 лет в среднем) пульпозный комплекс представляет собой желеобразный студень, почти жидкий «холодец». Но по мере замещения клеток нотохорды хондроцитоподобными клетками, мигрирующими из хрящевого слоя замыкательных пластин и внутреннего фиброзного кольца, «холодец» начинает «застывать». Это связано с естественной запрограммированной смертью (апоптозом) клеток нотохорды. В отличие от клеток нотохорды, которые, в основном, вырабатывают протеогликаны (аггрекан и др. белки, удерживающие воду), хондроцитоподобные клетки вырабатывают большое количество коллагена II типа и немного I типа. Это ответная компенсаторная реакция на увеличение веса человека и все возрастающие компрессионные и ударные нагрузки. Другими словами, диск начинает «взрослеть» и приобретать полноценные амортизирующие свойства. Вместе с тем, также начинают появляться первые признаки дистрофии и дегенерации, которые уже могут быть хорошо заметны с 12-летнего возраста.
Хондроцитоподобные и нотохордоподобные клетки в отличие от истинных клеток нотохорды вырабатывают большое количество коллагена II типа, из которого выстраивается матрикс (матрица) пульпозного комплекса. Это своеобразный «каркас» из хаотично переплетенных коллагеновых волокон II типа. Внешне он напоминает металлическую губку для мытья посуды. Такая структура очень упруга и легко восстанавливает форму после деформации. Таким образом, одним из основных отличий «взрослого» диска от молодого является наличие хорошо развитой опорной структуры для специализированных белков, обеспечивающих амортизационные свойства диска. Весь матрикс погружен в гель, образованный многокомпонентным белком аггреканом, который обладает высокой способностью связывать и удерживать воду, тем самым обеспечивая амортизирующую функцию диска за счет поддержания высокого осмотического (гидростатического) давления (420-450 mOsm). Аггрекан прикрепляется к нитям гиалуроновой кислоты, которые переплетаясь с волокнами коллагена II типа, создают устойчивые молекулярные формы. Вырабатывается хондроцитоподобными клетками, равномерно распределенными по матриксу диска. Именно благодаря аггрекану диск связывает воду и «набухает». В его составе присутствует отрицательно заряженные белки кератан сульфат и хондроитин сульфат, которые «поглощают» воду, удерживая ее в экстраклеточном матриксе. Например, при разрыве кольца (грыжа) и выходе геля наружу, он механически не ограничен, поэтому «набирая» воду фрагмент «разбухает» и может формировать большие грыжевые выпячивания. При этом грыжа может отторгать корешковую манжету с корешками и сопутствующими сосудами и прижимать их к суставу ПДС или ножке дуги (вышележащего) позвонка.
Второй тип клеток, населяющих пульпозный комплекс – фибробласты (как в фиброзном кольце). Вырабатывают коллаген I типа. Несмотря на свою незначительность, могут играть немаловажную роль в запуске необратимых дегенеративных процессов в диске.
Весь амортизационный комплекс «прошит» радиально расположенными эластическими волокнами, которые формируют упругий эластический скелет и позволяют легко восстанавливать форму диска после деформаций. Также эластических волокон много в наружных слоях диска и выполняют они ту же функцию – способствуют возврату в исходную форму.
Непосредственно клеточные популяции как нотохордоподобных, хондроцитоподобных так и фибробластов, заселяющих диск, живут в своих околоклеточных матрицах, своеобразных апартаментах.
Функция околоклеточного матрикса – структурная и защитная для клеток.
Здоровые клетки пульпозного комплекса постоянно поддерживают оптимальный уровень продукции коллагена II типа и аггрекана, тем самым обеспечивая необходимую целостность и структуру матрикса, уровень поглощения, удержания воды и набухания ткани диска – так называемый тургор диска.
Отличительной особенностью гелевой капсулы является полное отсутствие сосудистых капилляров и отсутствие иннервации. Белок аггрекан является «токсичным» для нервных окончаний. Соответственно, он препятствует прорастанию свободных нервных окончаний внутрь диска, тем самым предотвращая появление болевого импульса при сильных компрессионных нагрузках, которым подвергается диск.
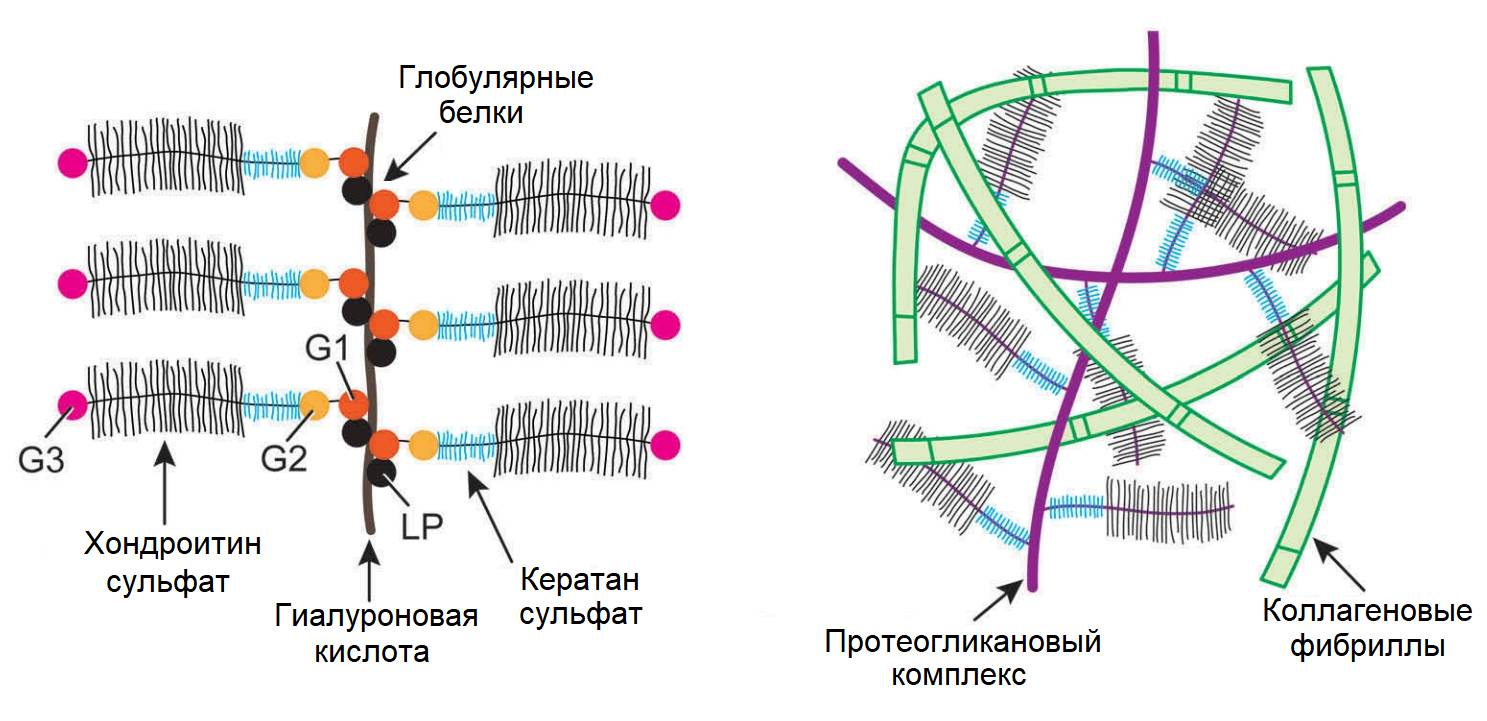
Аггрекановый комплекс и коллагеновый матрикс (Ad et al., 2000)
Межпозвонковый диск – самый крупный орган в теле человека, лишенный питания посредством сосудистой сети. Метаболизм и обменные процессы в диске всецело зависят от качества диффузии – механизма транспортировки питательных веществ через замыкательные пластины, непосредственного транспорта внутри матрикса и во многом от полноценной работы капиллярной сети позвонков. Диффузия питательных веществ и поддержание гомеостаза на должном уровне значительно зависят от условий, в которых работает диск. У предка человека чередование фаз сжатие-растяжение работало как насос, наполняющий капиллярную сеть внутри позвонков, что положительно сказывалось на диффузии и обменных процессах. Компрессионная нагрузка была всегда динамическая и кратковременная и значительного патологического влияния на метаболизм и обменные процессы в диске не оказывала. Скорей наоборот – стимулировала анаболизм и выведение продуктов обмена. В отличие от современного человека, у которого преобладает вертикальная статическая нагрузка в любом положении, кроме лежа. С переходом к прямохождению резко выросло требование к качеству диффузии и обеспечению обменных процессов внутри самого диска.
Если выражаться более точно, то не само прямохождение (как вид локомоции) ухудшает качество питания диска, а необходимость современного человека длительно выполнять работы в положении сидя или стоя с длительными периодами статической работы часто в комбинации с работой в эксцентрическом режиме (удержание веса перед собой плюс наклоны).
Для проведения питательных веществ через мембранный механизм замыкательной пластинки затрачивается около 2 часов (в среднем на 0,7 мм толщины пластинки) сквозь мембрану и еще около 4-5 часов транспортировки в центр диска. В среднем, в здоровом диске на доставку питательных веществ от границы капиллярного русла до центра диска затрачивается около 7-8 часов. И это при условии адекватной пропускной способности замыкательных пластин и полноценной работы капиллярной сети позвонков. Поэтому, чем выше диск (например, L4-5), тем больше времени понадобиться для прокачки питательных веществ с периферии. Выведение продуктов обмена идет по тому же пути диффузии, но только в обратном направлении. Поэтому популяция клеток центральной части диска всегда будет более уязвима в отношении питания и выведения продуктов обмена. Очень часто это физически невозможно, если нарушена диффузия через замыкательные пластины или нарушен капиллярный кровоток. Склерозирование замыкательных пластин может развиться после травмы или в результате длительного воздействия статических нагрузок. Нарушение пропускной способности капилляров, как правило, вызвано их спазмом в результате воздействия никотина (курение), вибрации (большие автомобили), снижением насосной функции мышц (длительное сидение) и сосудистыми заболеваниями (атеросклероз, диабет и др.).
В любом случае, доставка питательных веществ снижается настолько, что клетки не в состоянии поддерживать свой нормальный жизненный цикл. При этом также нарушено выведение продуктов обмена и идет процесс «самоотравления» клеток.
Поэтому естественная ходьба и кратковременные компрессионные нагрузки средней интенсивности улучшают качество диффузии и выступают анаболическим фактором, способствуя выработке клетками пульпозного комплекса структурных белков и коллагена II типа. Длительное нахождение в положении лежа, сидя или длительные компрессионные нагрузки даже низкой интенсивности выступают катаболическим фактором, приводя к ухудшению диффузии и снижению обменных процессов.
Анаболическое «окно» полноценного обмена в диске лежит в пределах 0,3-1,3 МРа (МПа; мегапаскаль). Для ориентировки: положение лежа – 0,1 МРа, компрессионная нагрузка может приводить к повышению давления до 3,0 МРа. Вся нагрузка ниже или выше значений 0,3-1,3 МРа является катаболической.
Осмотическое (гидростатическое) давление в диске лежит в диапазоне 420-450 mOsm, при этом оптимальное давление для выработки протеогликанов и экстраклеточного матрикса лежит в диапазоне 400 -500 mOsm (изоосмотическое и гиперосмотическое).
Кратковременный катаболизм тканей диска особой угрозы не представляет. Но, если речь идет о годах «катаболического стажа», тогда существует повышенный риск развития дегенеративного заболевания диска – межпозвонкового остеохондроза с последующим развитием в остеохондроз позвоночника. [Здесь нет никакой тавтологии. Это похожие по названию, но разные по клиническому проявлению «заболевания»].
При осмотическом (гидростатическом) давлении 0,3 МРа клетками синтезируется на 20% больше протеогликанов, чем при давлении 0,1 МРа (лежа). Высокая, но даже кратковременная компрессионная нагрузка выступает катаболическим фактором: замедляет, прекращает синтез структурных белков и вызывает их распад.
Весомым и, зачастую необоснованно игнорируемым фактором нарушения обменных процессов, является длительное сидение. Диск может выдержать кратковременную компрессионную нагрузку до 250 кг на см квадратный без последствий (до 9000N), но он бессилен против обычного длительного сидения изо дня в день из года в год. В здоровом диске снижение тургора наблюдается уже через 45 минут сидения. В стадии дистрофии диск «проседает» и «распластывается» уже через 20.
Отсюда возникает первая проблема – нарушение обменных процессов в диске при недостаточности диффузии.
Нарушение обменных процессов в диске при недостаточности диффузии
Обменные процессы в клетках зависят от ряда факторов: генетических, прилагаемой физической нагрузки, состояния периферических сосудов и пропускной способности замыкательных пластин.
В процессе жизнедеятельности диски постоянно подвергаются нагрузке, что приводит к частичному разрушению элементов матрикса и необходимости продукции новых аггрекановых комплексов на замену поврежденным.
В здоровом диске постоянно происходит смена анаболической и катаболической фаз. Клетки диска вырабатывают специальные ферменты (энзимы), которые разрушают и уничтожают поврежденные и отработавшие срок структурные элементы. Аггреканазы 1,2 (ADAMTS 4,5) «разрушают» и «растворяют» отработавший дефектный аггрекановый комплекс; матриксные металлопротеиназы (ММР 1,3 и др.) растворяют части поврежденного матрикса. Действие матриксных металлопротеиназ сбалансировано действием фермента-антагониста – тканевого ингибитора матриксных металлопротеиназ (TIMP 1 и 2), который блокирует (подавляет) действие основного «растворителя» и препятствует избыточному разрушению матрикса. TIMP 3 блокирует действие аггреканаз. Смена катаболической и анаболической фазы позволяет в текущем режиме устранять повреждения и проводить «чистку» внутренней среды диска. Т.е. постоянно происходит так называемое гомеостатическое ремоделирование пульпозного ядра.
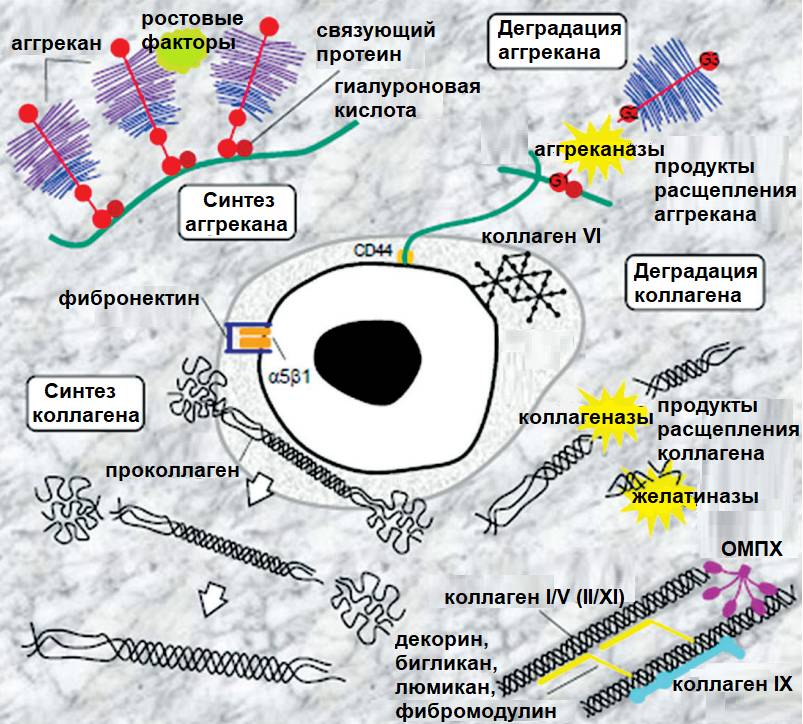
Хондроцитоподобная клетка и белки внеклеточного матрикса (Bendtsen et al., 2016)
Оптимальной средой для клеточного анаболизма является нейтральная среда. Колебания pH в диске лежат в диапазоне от 7,5 до 5,7. pH здорового диска – 7,1. Максимальный синтез структурных белков при pH 7,0. Клетки пульпозного ядра адаптированы работать в кислой и умеренно ишемической среде. Напряжение кислорода в пульпозном ядре может колебаться в диапазоне от 10% (нормоксия) до 0,5% (критическая гипоксия). Оптимальное для клеток – 1,5-5% (функциональная гипоксия). На периферии фиброзного кольца напряжение кислорода достигает 19%; центр пульпозного комплекса – 0,65%.
Снижение pH до 6,8 – прекращается синтез структурных белков пульпозного комплекса. Снижение pH до 6,5 ведет к дегенерации диска. Рабочий глюкозный диапазон в пределах от 0,8 до 5 mmol/L. Падение уровня глюкозы ниже 0.5 mmol/L больше чем на три дня и снижение pH ниже 6.4 приводит к смерти клеток.
Утрируя: смерть клеток пульпозного ядра – это смерть всего диска.
В природе существует запрограммированная смерть клеток (апоптоз) и регулируемая смерть клеток (пироптоз, некроптоз, ферроптоз).
Смерть клетки вызывается двумя механизмами: внутренним и внешним.
Внутренний путь смерти клетки вызван оксидативным стрессом, стрессом эндоплазматического ретикулума, повреждением ДНК или повреждением митохондрий. Итогом является активация цитозольных белков, отвечающих за апоптоз, с последующей деструкцией ядерных белков и цитоскелета, синтеза «рецепторов смерти», хемокинов (приманок) с целью привлечения и активации клеток, выполняющих фагоцитирующие функции.
Внешний механизм смерти клетки связан с активацией «рецепторов смерти» с помощью «лигандов смерти», синтезируемых клетками иммунной системы.
Для удобства восприятия выделяют три последовательные фазы дегенерации диска: 1) катепсинозависимая дегенерация (макрофагонезависимая), 2) воспалительная макрофагозависимая и 3) репаративная макрофагозависимая фаза. При травме диска дегенерация начинается сразу с воспалительной макрофагозависимой.
К пусковым причинам дегенерации диска относят: ишемию, ацидоз (критическое накопление лактата), прямую травму, оксидативный стресс, стресс эндоплазматического ретикулума, накопление продуктов гликации, метаболические нарушения на фоне генетической предрасположенности.
Ишемия и ацидоз. Катепсинозависимая дегенерация – остеохондроз бухгалтеров, водителей и прочих сидячих профессий. Метаболическое поражение диска.
Самый частый вопрос: «Ничего тяжелого не поднимаю, больших физических нагрузок нет. Почему начала болеть спина и почему появился остеохондроз?». Ответ прост: нарушение обменных процессов в диске, связанное с длительным «стажем» сидения.
Пусковым фактором выступает хроническая критическая ишемия диска вследствие длительного кислородного голодания и «закисания» диска. Снижение напряжения кислорода до 1 – 0,5 % и параллельное снижение pH вследствие накопления лактата приводит к ускоренному старению и смерти клеток пульпозного ядра.
Само по себе сидение вызывает очень низкую компрессионную нагрузку, которая не обеспечивает достаточный «помповый» механизм откачки метаболитов.
Для поддержания нормальной жизнедеятельности клеткам нужна энергия. Она производится двумя способами: оксидативное (окислительное) фосфорилирование (с участием кислорода) и гликолиз (без участия кислорода). Другими словами, энергия добывается или «горением», или «брожением». В обильно кровоснабжаемых тканях клетки предпочитают синтезировать энергию с участием кислорода (акцептор электронов), но подобная практика сопряжена с повышенным синтезом побочных продуктов – активных форм кислорода (АФК; Reactive oxygen species, ROS) и оксидативным стрессом, что может привести к повреждению митохондрий и гибели клеток. Обильное кровообращение (соответственно, обмен) позволяет в ускоренном режиме утилизировать побочные метаболиты и/или избавляться от погибших клеток. Межпозвонковый диск является самым крупным бессосудистым органом в теле человека, что жестко детерминирует его метаболизм. Оксидативное фосфорилирование как базовое не подходит в принципе, но кислород и «побочные» метаболиты митохондриального дыхания нужны клеткам как вторичные мессенджеры для запуска и контроля важных сигнальных путей, связанных с жизнедеятельностью клеток. Поэтому 75% энергии в клетке синтезируется благодаря анаэробному гликолизу, 25% – аэробному пути обмена.
За оксидативное энергообеспечение отвечает коактиватор-1α (PGC-1α), за гликолитическое – транскрипционный фактор под названием Фактор, индуцируемый гипоксией (Hypoxia-inducible factor 1-alpha; HIF).



