
Полная версия:
Домашнее винокурение и производство спиртных напитков

Леонид Пашков
Домашнее винокурение и производство спиртных напитков
Предисловие автора
История производства алкогольных напитков уходит далеко вглубь веков и неразрывно связана с историей самого человечества. Уже в самых древних дошедших до нас письменных источниках, начертанных клинописью на глиняных табличках несколько тысяч лет назад, есть упоминание о напитке сикера, похожем на пиво [13].
Много людей занимается у нас в той или иной мере любительским изготовлением спиртных напитков и виноделием. Это один из самых массовых видов народного творчества. К сожалению, любительские перегонные аппараты часто далеки от совершенства, а любителям не хватает информации в области виноделия и винокурения. К тому же литература по этим вопросам издается небольшими тиражами и потому малодоступна.
Перед вами, уважаемый читатель, книга, в которой сделана попытка кратко, но с достаточной полнотой и по возможности доступно изложить сведения по всей указанной тематике в их взаимосвязи. Насколько удачной она оказалась, не мне судить. Это, однако, не беллетристика, а техническая литература. Возможно, кому-то понадобится вспоминать школьные уроки химии, чтобы досконально во всем разобраться.
По разным причинам я долго откладывал составление этой книги. А начав, наконец, всерьез работать над рукописью, очень скоро понял, что знаний одного человека для охвата такого пласта технологий недостаточно. Пришлось надолго засесть в ГПНТБ – есть в Новосибирске такая библиотека – и пересмотреть горы литературы.
Современная технология производства спирта любителям не подходит. В связи с этим процессы и приемы получения спирта изложены здесь, в основном, по классическому сочинению, в котором собраны знания стародавних винокуров [1]. Очень ценная информация по изготовлению спиртных напитков содержится в прекрасном труде [2]. Сведения по изготовлению спирта и напитков из этих двух источников я, насколько смог, проверил на практике, чтобы адаптировать их к любительским условиям.
Список книг на русском языке по домашнему виноделию довольно большой. Но я посчитал интересным познакомить читателя с некоторыми материалами из малоизвестной у нас работы [15], где помимо других тем рассматривается также медоварение.
Важным подспорьем для любителя могут стать приведенные в первой части книги формулы расчетов, которые приходится производить в процессе изготовления спирта и напитков. Выполняя несложные вычисления вместо того, чтобы действовать на глазок, любитель сможет быстро и, что важно, без многократных проб получать нужные результаты. Применение формул в ряде случаев показано на примерах.
Особо стоит раздел спиртометрии. Я не мог воспользоваться официальными спиртометрическими таблицами, так как их перепечатка запрещена. Поэтому мне пришлось привлечь соответствующие данные, главным образом, из [10], [9], а также из других открытых источников. Недостающие величины были получены расчетом, а явно ошибочные цифры я уточнил интерполяцией. В любом случае числовые данные в таблицах предназначены только для ориентирования любителей. Сами таблицы, как и все материалы книги, на использование специалистами в области виноделия, производства спирта и спиртных напитков в их профессиональной деятельности не рассчитаны.
Одна из особенностей монографии [2], помимо квалифицированного изложения и широкого охвата материалов – ее авторы не только дают готовые рецепты, но побуждают специалистов к творчеству. Мне тоже хотелось бы, чтоб мои читатели не просто копировали известные напитки. Конечно, не надо бездумно отказываться от всего, что было создано до нас. Но без исканий не будет и находок. А чтоб найти свой собственный путь, следует сначала изучить опыт предшественников.
Изготовление хороших напитков – это искусство, которое требует немалых усилий, знаний и фантазии. А домашние напитки еще и отражают характер своих авторов.
Это как песни. Каждый поет их по-своему.
Глава 1
Получение спирта и домашнее винокурение
1.1. Спирт – получение и физические свойства
Этиловый спирт (другие названия: винный спирт, этанол) представляет собой прозрачную бесцветную жидкость с легким эфирным запахом, его химическая формула С2Н5ОН. Трудно найти отрасль, где бы не применялся спирт. Существует несколько способов производства спирта, отличающиеся в том числе используемым видом сырья.
Для изготовления напитков используют только спирт, полученный из пищевых продуктов. На эти цели употребляют продукты, содержащие сахар (сахарный тростник, сахарная свекла, виноград и др.) или крахмал (зерно различных культур, картофель).
Разложение сахара на спирт и углекислый газ, которое может происходить в соках или водных растворах сахара под воздействием микроорганизмов, называется спиртовым брожением. Уравнение спиртового брожения при получении спирта из глюкозы (виноградного сахара) предложил в 1810 году французский ученый Гей-Люссак:
С6Н12О6 = 2С2Н5ОН + 2СО2.
глюкоза этиловый спирт углекислый газ
Для возбуждения спиртового брожения используются одноклеточные грибы – дрожжи. Во время брожения выделяется тепло.
Сахароза (свекловичный или тростниковый сахар) является дисахаридом. Ее молекула состоит из двух молекул простых сахаров, лишенных одной молекулы воды. При сбраживании сахароза под воздействием ферментов дрожжей сначала разделяется с присоединением воды на два простых сахара – глюкозу и фруктозу. Их молекулы имеют одинаковый химический состав, но разное строение. Затем образование спирта идет по уравнению Гей-Люссака. Уравнение брожения сахарозы имеет следующий вид:
С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6 = 4С2Н5ОН + 4СО2.
сахароза вода глюкоза фруктоза этиловый спирт углекислый газ
По своему химическому строению крахмал является полимером, состоящим из молекул глюкозы, у каждой из которых отнята одна молекула воды. Химическая формула крахмала nС6Н10О5. Сам крахмал дрожжами не сбраживается, для этого необходимо предварительно разделить его на отдельные молекулы и присоединить к ним воду. Этот процесс, который носит название осахаривание, происходит при участии ферментов проросшего зерна – солода. Ферменты солода воздействуют на крахмал, в результате осахаривания из крахмала получается дисахарид мальтоза по уравнению:
2nС6Н10О5 + nН2О = nС12Н22О11
крахмал вода мальтоза
Под воздействием дрожжей мальтоза сбраживается по тому же уравнению, что и сахароза. Разница состоит в том, что при ее разложении образуется только глюкоза.
В уравнениях сбраживания сахаров и крахмала здесь приведены лишь начальные и конечные формулы веществ, участвующих в брожении. На самом деле эти процессы протекают сложнее, с образованием промежуточных и побочных соединений. Мы не будем их рассматривать. Скажем только, что брожение – это способ анаэробного (без воздуха) дыхания дрожжей. Сахар является материалом для дыхания, а образующийся спирт – всего лишь побочный продукт жизнедеятельности дрожжей [4].
Можно вычислить теоретический выход спирта для всех трех приведенных выше уравнений. Так, из 100 г глюкозы (или фруктозы) теоретический выход спирта составляет 51,14 г, или 64,79 мл; из 100 г сахарозы выход спирта равен 53,83 г, или 68,19 мл, а из 100 г крахмала – 56,82 г, или 71,98 мл. Практический выход спирта меньше теоретического. Причин уменьшения выхода спирта много, назовем основные.
1) Неполное осахаривание крахмала при переработке на спирт крахмалистого сырья. Хорошее осахаривание крахмала можно получить, если применять качественный солод, выдерживать в допустимых пределах соотношение между солодом и крахмалосодержащими продуктами, а также соблюдать нужный температурный режим.
2) Недоброд (неполное сбраживание) сахара. Часть сахара остается несброженной даже при его невысокой концентрации в растворе. Уменьшить недоброд можно, если применять качественные дрожжи и соблюдать оптимальные условия брожения.
3) Образование в процессе брожения, помимо спирта и углекислого газа, побочных соединений. Так, в соответствии с числами Пастера, из 100 весовых частей сахара при нормальном брожении образуется примерно 48,4 весовых частей спирта; 46,6 весовых частей углекислого газа; 3,3 части глицерина; 0,6 части янтарной кислоты и 1,2 весовой части других соединений [15]. Как указано в [12], потери сахара в данном случае составляют 2,5 %. Важно отметить, что примеси образуются даже при нормальном течении процесса брожения. При сбраживании различных продуктов образуется свой особый количественный и качественный состав примесей. Примеси влияют на свойства будущих напитков. Но при отклонении от оптимальных условий брожения количество примесей может значительно возрасти – следовательно, уменьшится выход спирта.
Много примесей образуется при переработке на спирт дефектного сырья. Даже на спиртзаводах очистка такого спирта является сложной задачей. В любительских условиях следует вообще отказаться от использования подпорченного зерна, плодов и т. д.
4) Испарение и унос образовавшегося спирта с углекислым газом при брожении. На спиртзаводах для предотвращения уноса применяют специальные ловушки. Для уменьшения уноса спирта в любительских условиях надо поддерживать температуру брожения на нижнем уровне оптимальных значений.
5) Потери спирта при снятии с осадка сбродившего сусла и переливках вина. В домашних условиях спирт из осадков обычно не извлекают, их просто выбрасывают.
6) Неполное извлечение спирта из спиртосодержащей жидкости в процессе перегонки. Однозначного ответа на вопрос о достаточной полноте извлечения спирта не существует, это зависит от ряда обстоятельств. При малой концентрации спирта в жидкости любитель может затратить столько времени и энергии (топлива) на его извлечение и укрепление, что эти затраты намного превысят стоимость полученного спирта.
7) Механические потери спирта (проливы, прилипание к стенкам сосудов и т. п.). Здесь можно лишь напомнить о необходимости быть аккуратным в работе.
По принятым в промышленном виноделии нормативам наброд спирта из 100 г сахарозы составляет 62 мл, а из 100 глюкозы или инвертного сахара – 58,9 мл [7]. Однако в [15] дана цифра наброда – 60 мл спирта из 100 г сахарозы. Думаю, она более верно отражает любительскую практику, и в наших расчетах мы ее и будем применять.
Высокопроцентный спирт сильно поглощает влагу из воздуха, из растительных и животных тканей. Пить спирт в неразбавленном виде не рекомендуется.
Спирт смешивается с водой в любых соотношениях. При этом происходит небольшое сжатие объема смеси (контрактация) и выделяется тепло. Сжатие носит закономерный характер, то есть может быть вычислено.
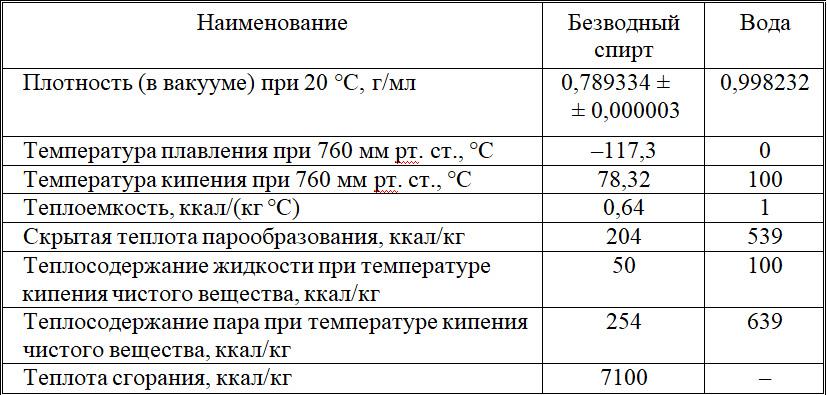
Некоторые характеристики спирта и воды приведены в таблице 1 – 1.
Таблица 1 – 1
Некоторые физические характеристики этилового спирта и воды
1.2. Спиртометрия
На практике применяют не стопроцентный безводный (абсолютный) спирт, а так называемые водно-спиртовые растворы, другое название – водно-спиртовые смеси. Поэтому существует необходимость в определении их физических свойств. Для этих целей была создана отдельная область измерений, которую назвали спиртометрия.
1.2.1. Определение содержания спирта в растворах
Существует две системы измерения содержания спирта: объемная и весовая.
В объемной системе содержание спирта в водно-спиртовом растворе, или его крепость, выражается в миллилитрах безводного спирта на 100 миллилитров раствора. Другое название этой величины – объемные проценты, обозначение % об.
Если, например, в 100 мл водно-спиртового раствора содержится 40 мл безводного спирта, то, значит, крепость раствора равна 40 % об. Содержания спирта на этикетках спиртных напитков указывается именно в объемных процентах.
По весовой системе количество спирта в водно-спиртовом растворе выражается в граммах спирта на 100 грамм раствора, иначе в весовых процентах, обозначение % вес. Например, запись 33,3 % вес означает, что в 100 г раствора содержится 33,3 г безводного спирта. Термин «крепость» в весовой системе не применяют.
Как известно, плотность жидкости (а значит, и занимаемый объем при неизменной массе) зависит от ее температуры. На этом, кстати, основано применение подкрашенного спирта в термометрах. Но данное свойство создает неудобства при пользовании объемной системой в целях учета спирта. По этой причине в технических расчетах применяется система весовых процентов: вес от температуры не зависит.
На практике содержание спирта в водно-спиртовом растворе определяют не напрямую, а косвенно – по его плотности. С этой целью разработаны специальные таблицы. Для правильного измерения содержания спирта в водно-спиртовом растворе надо, чтобы раствор содержал только воду и этиловый спирт, а его температура была равна 20 °C, на которую рассчитаны таблицы. Заметим, что в данной книге все соответствующие величины также даны для 20 °C, кроме отдельных оговариваемых случаев.
Плотность жидкостей измеряют ареометром (другие названия прибора: плотномер, денсиметр). Принцип действия этого прибора основан на законе Архимеда. Прибор представляет собой трубку, зауженную в верхней части, и напоминает ампулу для лекарства или бутылочку с длинным горлом (рис. 1). Чем больше объем нижней утолщенной части ареометра и чем тоньше его верхняя часть со шкалой для снятия показаний, тем с большей точностью можно вести измерения плотности.
Ареометры градуируются в граммах на миллилитр объема (г/мл). Существуют, однако, ареометры, градуированные непосредственно в объемных процентах спирта, они называются спиртометрами. При их использовании таблицы не нужны.
Измерение плотности выполняется следующим образом. В мерный цилиндр (пробирку) наливают испытуемый раствор и доводят его температуру до 20 °С. Затем ареометр осторожно опускают в налитый раствор. При этом ареометр не должен касаться стенок и дна мерного цилиндра. Отсчет значения плотности производят от верха шкалы ареометра до точки, находящейся на границе погружения ареометра в раствор.
Способ определения концентрации спирта в растворе по его плотности неприменим в тех случаях, когда в растворе помимо спирта и воды содержатся другие ингредиенты (например, сахар), так как они будут влиять на плотность раствора. Поэтому количество спирта, содержащегося в ликере или вине, определяют не в самом напитке, а в отгоне, полученном перегонкой напитка. Делается это так. Из взятой пробы отгоняют весь спирт, а затем в отогнанный спирт добавляют дистиллированную воду до первоначального объема пробы. И уже на этом разведенном отгоне проводят измерения.
Измерив плотность раствора, находят затем содержание спирта с помощью таблиц. Здесь это таблица 1 – 2, в которой приведены основные данные по спиртометрии. Форму таблицы придумал я сам, она имеет некоторые особенности.
Таблица 1 – 2 включает в себя как бы несколько таблиц сразу.
Столбец 4 и столбцы влево от него заключают в себе данные по спиртометрии растворов в системе объемных процентов. При пользовании этой частью таблицы цифры в столбце 4 следует считывать как объемные проценты;
Столбец 4 и столбцы вправо от него содержат данные по спиртометрии растворов и образующихся из них паров в системе весовых процентов. В этой части таблицы цифры в столбце 4 следует считывать как весовые проценты.
Двойное прочтение процентов на первый взгляд кажется неудобным, к нему надо привыкнуть. Зато в одной таблице удалось собрать все наиболее часто используемые данные. Предоставляемые возможности, наглядность и удобство этой таблицы читатель оценит, как только начнет активно ею пользоваться.
В самом начале табл. 1 – 2 (столбец 4 и вправо от него) даются сведения о концентрации спирта в парах при содержании его в жидкости от 0,1 до 1,5 % вес. В столбцах, относящихся к системе объемных процентов, в этом месте данные не приводятся.
Думаю, читатель согласится, что измерение содержания спирта в водно-спиртовых растворах с точностью до 1 % об для домашнего винокурения вполне приемлемо.
Определим требуемую точность измерения плотности для этого случая.
Плотность воды равна 1 г/мл, плотность спирта равна примерно 0,8 г/мл. Разность между этими значениями составляет 1 – 0,8 = 0,2 г/мл. Значит, при изменении крепости спирта на один процент его плотность изменяется в среднем на величину 0,002 г/мл. Учитывая неравномерность (нелинейность) зависимости содержания спирта от плотности раствора, примем требуемую точность измерения плотности равной ± 0,001 г/мл.
По моему опыту, для измерения плотности растворов с такой точностью во всем диапазоне удобно пользоваться не одним, а тремя ареометрами соответственно на пределы 0,76 – 0,84 г/мл; 0,84 – 0,92 г/мл; 0,92 – 1,0 г/мл. При использовании этих ареометров достаточно иметь пробирку (мерный цилиндр) емкостью всего лишь 50 мл.
Забегая вперед, скажем, что для измерения плотности сусла и сахарных растворов понадобятся ареометры на пределы 1,0 – 1,08 г/мл; 1,08 – 1,16 г/мл. Стеклянные ареометры на указанные пределы измерения выпускаются нашей промышленностью. Можно применять и другие ареометры, имеющие точность измерения ± 0,001 г/мл.
Ниже даны примеры определения содержания спирта в растворах.
Пример 1 – 1. Измеренная ареометром плотность водно-спиртового раствора равна 0,947 г/мл. Определить содержание спирта в этом растворе в объемных процентах.
Решение. В таблице 1 – 2 значения плотности даны с точностью до пятого знака после запятой. Для удобства расчета припишем к нашей величине плотности 0,947 г/мл два нуля и получим число 0,94700. По таблице 1 – 2 в столбцах 3 и 4 находим близкую большую по значению плотность 0,94806 для спирта крепостью 40 % об и близкую меньшую 0,94643 для спирта 41 % об. Значит, крепость раствора больше 40 % об и меньше 41 % об. Далее находим разность между числами 0,94806 и 0,94700. Она равна 0,00106. Затем находим разность между числами 0,94700 и 0,94643. Она соответственно равна 0,00057. Число 0,00057 меньше числа 0,00106. Значит, крепость раствора с плотностью 0,94700 ближе к 41 % об, чем к 40 % об. Принимаем крепость данного раствора равной 41 % об. При этом ошибка расчета составила меньше, чем 0,5 % об.
Пример 1 – 2. По значению плотности примера 1 – 1 определить содержание спирта в растворе, выраженное в весовых процентах.
Решение. По таблице 1 – 2 в столбцах 5 и 4 находим близкие большую и меньшую по значению плотности 0,94860 для 33 % вес и 0,94679 для 34 % вес. Затем проводим вычисления аналогично предыдущему примеру, и в результате получим содержаниеспирта в растворе, равное 34 % вес. Эти вычисления вы можете проверить сами.
1.2.2. Весовая и объемная системы – переход из одной в другую
Существуют формулы, в которых отражена связь между двумя системами измерения содержания спирта в водно-спиртовых растворах. Зная плотность раствора и численное значение процентов спирта, соответствующее данной плотности в одной системе, можно определить численное значение процентов спирта в другой системе, не пользуясь таблицей 1 – 2. Ниже даны эти формулы.
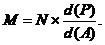
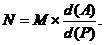
Принятые обозначения:
M – численное значение содержания спирта в данном растворе, выраженное в % об;
N – численное значение содержания спирта в этом же растворе, выраженное в % вес;
d (Р) – плотность данного раствора, г/мл;
d (А) – плотность абсолютного (безводного) спирта. Здесь и в дальнейших расчетах она в соответствии с [10] принята равной 0,78934 г/мл.
1.2.3. Определение веса спирта в растворах
Иногда требуется определить количество спирта в растворе, выраженное в единицах веса. Для этого используют уже известный способ определения количества спирта в процентах и на его основе вычисляют вес.
Последовательность определения веса спирта следующая.
1) Определяют плотность водно-спиртового раствора.
2) По плотности раствора определяют с помощью таблицы 1 – 2 процентное содержание спирта в объемной или весовой системе, как было рассмотрено выше.
3) С помощью одной из приведенных формул 3 или 4, выражающих зависимость между процентным содержанием спирта и его весовым содержанием, находят вес спирта в 100 мл раствора.
Формулы для определения весового содержания спирта:
а) для объемныхпроцентов: S сп = M ×d (A). (3)
б) для весовых процентов: S сп = N ×d (P). (4)
Принятые обозначения:
S сп– весовое содержание спирта в водно-спиртовом растворе, г/100 мл;
M–содержание спирта в растворе, выраженное в объемных процентах % об;
N – содержание спирта в растворе, выраженное в весовых процентах % вес;
d (P); d (А) – см. обозначения в формулах 1 и 2.
После определения весового содержания спирта, выраженного в граммах на 100 мл раствора, остается только вычислить вес спирта Gсп, кг,во всем имеющемся объеме спиртового раствора Vсп, л, по формуле:
Gсп = 0,01 Vсп ×Sсп. (5)
Коэффициент 0,01 служит здесь для пересчета величин, выраженных в разных единицах измерения. В данном случае это граммы на 100 миллилитров (Sсп), килограммы (Gсп)и литры (Vсп). Ниже мы также будем сталкиваться в формулах с подобными коэффициентами, но можем и не объяснять их происхождение.
1.2.4. Разведение и укрепление водно-спиртовых растворов
Разводить и укреплять спиртосодержащие жидкости можно только одним способом, а именно добавляя в них нужный компонент. При разведении крепкого спирта в него добавляют воду или слабый спирт, а при укреплении слабого спирта в него добавляют крепкий спирт.
Все формулы в данном разделе рассчитаны на объемную систему учета спирта.
Рассмотрим варианты.
1) Разведение спирта водой
Объем воды для разведения имеющегося объема крепкого спирта до заданной крепости определяется по следующей формуле:
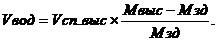
Принятые обозначения:
Vвод – объем воды для разведения, л;
V сп. выс – объем раствора спирта высокой крепости, л;
M выс – содержание спирта в растворе высокой крепости, % об;
M зд – заданная крепость раствора после разведения, % об.
Суммарное количество полученной смеси V см в литрах определяется сложением исходного объема крепкого спирта и добавки воды, то есть:
V см = V сп. выс + V вод. (7)
Если же суммарный объем раствора после разведения Vсм заранее задан, то необходимый объем крепкого спирта Vсп. выс можно вычислить по формуле 8:
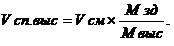
Объем добавочной воды V вод определится, как: V вод = V см – V сп. выс.
В приведенных формулах не учитывается сжатие смеси. Ниже мы рассмотрим этот вопрос. Кстати, чтобы не рассчитывать сжатие, на заводах пользуются для смешивания емкостями с разметкой. Делается это так. В емкость вливают известный объем крепкого спирта. Затем туда добавляют при перемешивании расчетное количество воды. Через некоторое время в емкость еще добавляют немного воды до требуемой отметки.

