
Полная версия:
Виртуальный ты. Как создание цифровых близнецов изменит будущее человечества
Исследования того, как импульсы распространяются по нервам, восходят к разработке метода «зажима напряжения» в 1930-х и 1940-х гг. биофизиком Кеннетом Коулом (1900–1984) из США вместе с Аланом Ходжкином (1914–1998) и Эндрю Хаксли (1917–2012) из Великобритании, которые нашли способ проводить измерения, продевая электроды в гигантский аксон – нервную клетку – кальмара.

Рисунок 5. Клеточная структура пробки, представленная Робертом Гуком, «Микрография» (1665)
Еще лучшее понимание «проводки» тела стало возможным благодаря технике, которая позволяет регистрировать мизерные электрические токи силой около пикоампера (миллионная миллионной доли ампера), которые проходят через одиночный ионный канал, одну молекулу или комплекс молекул, позволяющий ионам проникать через мембрану клетки. В 1976 г. немецкие клеточные физиологи Эрвин Неер и Берт Закман сообщили, как это сделать с помощью крошечного, но простого устройства, называемого локально-изолирующим электродом.
Они использовали кончик чрезвычайно тонкой стеклянной пипетки, чтобы прикоснуться к крошечному участку внешней мембраны клетки, который, по счастливой случайности, содержал единственный ионный канал. Небольшое всасывание обеспечивало герметичное уплотнение, так что ионы могли течь только из канала в пипетку. Используя чувствительный электрод, они смогли зафиксировать крошечные изменения тока, когда ионы проходили через зажатый канал. За это замечательное открытие в 1991 г. Неер и Закман получили Нобелевскую премию.
Но данные, которые привлекли наибольшее внимание в последние годы, связаны с чтением генетического кода человека. За это мы можем поблагодарить британца Фредерика Сэнгера (1918–2013), одного из величайших новаторов в молекулярной биологии: «Из трех основных видов деятельности, связанных с научными исследованиями – мышлением, разговорами и действиями, я предпочитаю последний и, вероятно, именно он у меня лучше всего получается»[44]. Он был прав. Став первым, кто раскрыл структуру белка (это оказался инсулин), Сэнгер в середине 1970-х разработал методы секвенирования ДНК, за что во второй раз стал лауреатом Нобелевской премии.
Со времени новаторской работы Сэнгера стоимость секвенирования человеческого генома (генетического кода в ДНК человека) резко упала – с миллиардов долларов до сотен. Одной из причин является появление секвенирования «следующего поколения» – прорыва, который сравнивают с переходом от самолета братьев Райт к современному Боингу.
В 1997 г. химики Кембриджского университета Шанкар Баласубраманиан и Дэвид Кленерман начали разрабатывать свой метод, согласно которому образец ДНК делится на фрагменты, которые иммобилизуются на поверхности чипа и локально амплифицируются. Затем каждый фрагмент декодируется, вплоть до «буквы» генетического кода (нуклеотида – подробнее позже), с использованием флуоресцентно окрашенных букв, добавленных ферментом. Обнаружив цветные буквы, включенные в каждую позицию чипа, и повторив этот цикл сотни раз, можно прочитать последовательность каждого фрагмента ДНК[45].

Рисунок 6. Метод локальной фиксации потенциала. Адаптировано из книги Александра Д. Рейеса «Прорывной метод, который стал жизненно важным для нейробиологии» (A Breakthrough Method that Became Vital to neuroscience). (Nature, 2019)
Еще одно достижение в области секвенирования нового поколения относится к 1970-м гг., когда Стив Хладки и Денис Хейдон из Кембриджа зафиксировали поток тока через одиночный ионный канал в искусственной мембране. Поскольку ДНК является заряженной молекулой, она также может пройти через этот открытый канал и при прохождении вызывает колебания тока, соответствующие генетической последовательности. Последующее развитие коммерческого «нанопорового секвенирования» компанией Oxford Nanopore Technologies (в частности, ее основателем Хэганом Бэйли) можно проследить до исследований 1980-х гг., когда впервые было обнаружено движение ДНК через поровые белки[46].
Используя новую технологию секвенирования, можно считывать значительно более длинные участки ДНК, чем ранее, поэтому в 2021 г. международная группа из 30 учреждений – Консорциум Telomere-to-Telomere (T2T) – опубликовала первый «длинно читаемый» геном[47]. Это было важное открытие, поскольку исторический проект последовательностей человеческой ДНК, опубликованный в июне 2000 г., пропускал целых 15 % генома: более ранние технологии секвенирования параллельно считывали код миллионов фрагментов ДНК, каждый из которых был относительно небольшим и содержал до 300 букв кода. В результате они не могли справиться с повторяющимися участками кода ДНК, скрывающимися в геноме, особенно с центромерами – защемленными частями хромосом, которые играют ключевую роль в делении клеток. Сквозная последовательность 2021 г., основанная на длинном чтении от 10 000 до 100 000 букв, выявила 115 новых генов, кодирующих белки, и, вероятно, содержит множество областей, которые играют роль в регуляции генов и других функциях.
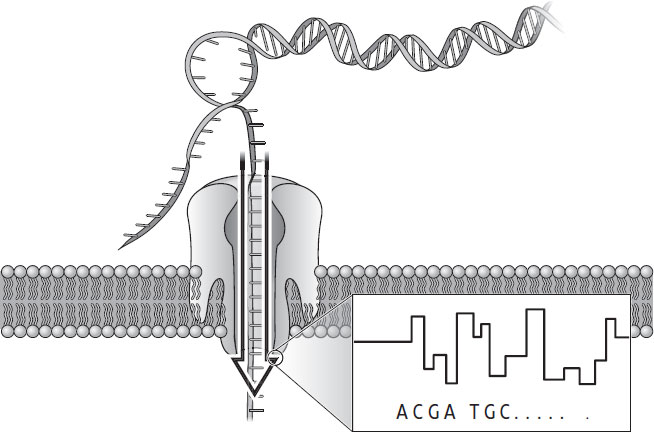
Рисунок 7. Как ДНК, проходящая через канал нанопоры, генерирует сигнал (дизайн – Ёритака Харазоно. TogoTV. cc BY 4.0)
Код жизни
Два десятилетия назад, когда на горизонте появились детали всего генетического кода человека, вопрос о том, какие данные необходимы для определения человеческого существа, имел соблазнительно простой ответ. Детали сложной структуры тела, казалось, заключены в ДНК – самом известном биологическом носителе информации. В начале этого столетия общественность была убеждена, что понимание кода ознаменует эру персонализированной медицины.
Биологи знали, что человеческий геном является чрезвычайно важным ресурсом, и в этом не может быть никаких сомнений. Копия находится в каждой из ста триллионов ваших клеток (за исключением красных кровяных клеток – они разрушают свою ДНК, чтобы переносить как можно больше кислорода, оставаясь при этом достаточно маленькими, чтобы проходить через капилляры). Подобно томам вашей «библиотеки», ДНК упакована в коробки, известные как хромосомы. Обычно в клетках человека имеется 46 хромосом. Если взять самую большую хромосому (вторую), то ДНК, содержащаяся в ней, в развернутом виде будет иметь размер более 8 сантиметров[48].
Используя рентгеновские лучи для изучения скрученной спиральной ДНК в каждом из этих пучков, можно понять, как она передает данные. Внутри двойной спирали ДНК находится лестница закодированной информации, где каждая «ступенька» состоит из двух химических единиц, называемых нуклеотидными основаниями. Эти единицы бывают четырех типов: аденин А, тимин Т, гуанин G и цитозин С. Из-за своей формы и химических свойств основания всегда образуют пары внутри ступени одинаковым образом: C соединяется только с G, а A соединяется только с T. В наших 46 хромосомах шесть миллиардов таких букв.
Вот почему двойная спираль также хранит секрет того, как клетки могут передавать свои инструкции после деления: если разделить нити двойной спирали, ступеньки лестницы разделятся на взаимодополняющие основания. Каждая полученная цепь может действовать как шаблон для копирования исходной партнерской цепи и сохранять информацию о том, как создавать белки, которые строят тело и управляют им (с помощью множества механизмов коррекции клеточных ошибок).
Порядок, в котором появляются основания, описывает код жизни аналогично буквам в этом предложении, только сообщения, которые они несут, содержат инструкции по созданию белка – одного из строительных блоков клеток – посредством вмешательства родственной генетической молекулы, называемой РНК. Информация в генах записана в трехбуквенном коде, причем тройка букв ДНК – кодон – отвечает за определенную аминокислоту, которая при соединении с цепочкой других аминокислот сворачивается в белок – один из блоков, которые строят ваши клетки и управляют ими.
Несмотря на то, что существует всего 20 различных аминокислот, для создания вас клетки вашего тела используют огромное количество комбинаций из таких разных белков, как гемоглобин (красный пигмент, который переносит кислород в вашей крови), инсулин (сигнальная молекула, которая сыграла главную роль в Нобелевской премии Сэнгера), или фермент АТФ-синтаза (преобразующая энергию молекулярная машина, примерно в 200 000 раз меньше булавочной головки, вращающаяся со скоростью 60 раз в секунду, производя энергетическую валюту нашего тела – молекулу под названием АТФ).
Всего, как говорилось ранее, в организме насчитывается около 37,2 триллиона клеток, и, хотя они (за парой исключений, таких как эритроциты по ранее упомянутым причинам) содержат всю информацию ДНК человека, каждый вид клетки во взрослом организме зависит от использования только определенного подмножества генов в геноме. Таким образом, клетки могут специализироваться на одном типе: от нервных и мышечных до клеток, населяющих органы, например мозг и сердце. Неудивительно, что многие думают, будто человеческий геном содержит все ответы, когда дело касается биологии человека.
За гранью ДНК
Первым человеком, который узнал о своих собственных генетических данных – и их ограничениях – был пионер геномики и предприниматель Крейг Вентер[49], который в 2000 г. возглавил частную попытку создать первый черновой вариант последовательности генома человека. 4 сентября 2007 г. группа под руководством Сэма Леви из Института Дж. Крейга Вентера в Роквилле, штат Мэриленд, завершила чтение генетического кода Вентера, что ознаменовало публикацию первого полного (шесть миллиардов букв) генома отдельного человека[50].
Роджер редактировал автобиографию Вентера «Расшифрованная жизнь»[51] и помнит, что даже Вентер был удивлен тем, как мало его геном смог раскрыть. В то время никто не знал, как правильно читать геномы. Это одна из причин, почему в более позднем проекте под названием Human Longevity Inc. (HLI) Вентер, как и Лерой Худ и другие, не только собрал геномную информацию, но и связал ее с фенотипами: анатомией, физиологией и поведением пациентов, от когнитивных онлайн-тестов до эхокардиограммы и анализа походки[52].
С помощью HLI скрининг выявил широкий набор дополнительных рисков возрастных хронических заболеваний, связанных с преждевременной смертностью, и улучшил интерпретацию полногеномного анализа[53]. «В клинике мы каждый день спасаем жизнь по крайней мере одному человеку, обнаруживая серьезную опухоль, о которой он даже не подозревал», – сказал нам Вентер, приводя несколько убедительных, но анекдотических примеров. В его случае, когда обычные методы объявили его свободным от рака, скрининг HLI выявил рак простаты, который начал распространяться. У нобелевского лауреата Хэма Смита, давнего сотрудника Вентера, обнаружили серьезную опухоль легких. Эти своевременные диагнозы были поставлены не на основе генетики, а с помощью мощного МРТ-сканера мощностью 3 Тесла (примерно в 60 000 раз сильнее, чем магнитное поле Земли) с расширенным анализом изображений. Вентер рассказал нам, что в этом сканере «опухоли загораются, как лампочки»[54].
Фенотип (то есть наблюдаемые черты и характеристики тела, от цвета глаз до рака) очень далек от генотипа или генетического рецепта тела. Думать, что единственный вид данных, обнаруженный в геноме, может раскрыть суть человека, – все равно, что пытаться определить внешний вид, вкус и ощущение торта по рецепту. Некоторые вещи – фрукты и смородина – сразу понятны, но многие другие гораздо менее очевидны.
Хотя секвенирование человеческого генома ознаменовало конец почти столетних усилий по поиску генов, кодирующих белки, оно подчеркнуло, как мало мы знаем о регуляторных элементах, не кодирующих белки, но составляющих геном[55]. Из трех миллиардов букв ДНК в геноме человека только около 2 % кодируют белки, которые строят и поддерживают наше тело. Хотя последние два десятилетия стали золотым веком открытия генов, около 20 % человеческих генов с жизненно важными функциями остаются окутанными тайной (согласно исследованию неизвестного генома, проведенному Шоном Манро из Лаборатории молекулярной биологии в Кембридже и Мэтью Фриманом из Школы патологии Данна Оксфордского университета)[56]. Нам предстоит еще много работы, помимо понимания генов. Когда-то интроны были среди огромных участков человеческой ДНК (около 98 %), отбрасываемых, как бессмысленный мусор. Теперь мы знаем, что эти некодирующие области генома содержат важные регуляторные элементы, которые определяют, как контролируется экспрессия генов, но всего мы по-прежнему не понимаем[57].
Также огромный всплеск интереса к использованию генов в организме произошел в области, называемой эпигенетикой. Деление клеток на разные типы связано с особенностями экспрессии генов, а не с изменениями в самой ДНК. Питательная среда начинается с хромосомы – пучка ДНК в наших клетках. Хромосомы четко организованы, как и белки, которые с ними взаимодействуют, и эта организация, по-видимому, важна для использования генов[58]. Паттерны использования генов могут быть основаны на химических модификациях ДНК (например, украсив ген химическими фрагментами, называемыми метильными группами, вы его выключите), а также на гистонах – крошечных белках, которые прикрепляются к ДНК, как бусины на ожерелье, и играют роль в упаковке ДНК и регулировании способа активации генов. В результате связь между генотипом и фенотипом не является прямой.
От ДНК к белку
Истории ДНК могут быть запутанными. Традиционные генетические исследования искали вариант ДНК, связанный с определенным заболеванием. Иногда все просто: мутации в гене, ответственном за фактор свертывания крови, вызывают наследственное заболевание – гемофилию, которую иногда называют королевской болезнью, поскольку она широко распространена в европейских королевских семьях.
Однако зачастую эти корреляции рассказывают сложную историю. Когда дело доходит до распространенных заболеваний головного мозга, таких как шизофрения и болезнь Альцгеймера, огромный объем информации поступает в результате полногеномного поиска ассоциаций (GWAS), в котором исследователи стремятся сравнить генетические последовательности тысяч людей с определенным признаком. Хорошей новостью является то, что сотни геномных регионов могут быть связаны с риском развития заболевания головного мозга у человека. Но иногда это триумф данных над пониманием. Объяснение того, почему спектр генетических вариантов влияет на здоровье, остается сложной задачей[59]. Даже если мы действительно связываем варианты с заболеванием, исследования диабета, например, показали, что на генетику приходится только около 10 % различий, наблюдаемых при заболевании, а остальное зависит от образа жизни и питания[60].
Сопоставление данных о генотипе с фенотипом осложняется тем фактом, что количество наших генов значительно превосходит количество белков. Гены можно перетасовать и использовать разными способами. Способность каждого гена кодировать множество белков обусловлена процессом, известным как альтернативный сплайсинг, при котором биты кода, называемые интронами, соединяются, а оставшиеся части гена, известные как экзоны, при создании белка могут включаться или бездействовать. Теоретически из одного гена можно получить до 100 белков[61].
Даже при кодировании участков ДНК не существует прямого соответствия между линейным кодом ДНК и трехмерной формой белков в организме, что имеет решающее значение для их работы – например, для ускорения клеточной химической реакции. Для белка, содержащего всего 100 аминокислот, число альтернативных структур, которые он может принять в водной среде клетки, колеблется где-то между 2100 и 10100 возможных конформаций (форм). Изучение каждой из них заняло бы вечность, но этот одномерный код приобретает правильную трехмерную форму (что имеет решающее значение для его работы) с помощью различных видов поддержки.
Одним из способов принятия правильной формы является непрерывное движение молекул в клетках, вызванное тепловой энергией. Многие из жизненно важных компонентов живой клетки достаточно малы, чтобы подвергаться постоянным ударам моря окружающих молекул (броуновское движение), что может помочь белку принять наиболее стабильную форму, даже если количество возможных стабильных конфигураций варьируется от миллионов до триллионов[62]. Кроме того, существует множество механизмов точной настройки того, как организм интерпретирует генетические данные и превращает их в белки.
Некоторые из способов, помогающие белкам сворачиваться в наших клетках, можно найти в замечательной молекулярной машине, называемой рибосомой, состоящей из примерно полумиллиона атомов и размером около одной миллионной дюйма в поперечнике. Эта машина лежит в центре двух эпох жизни на Земле: одной – знакомой, а другой – окутанной тайной. Первая состоит из сегодняшних живых существ, основанных на ДНК, а вторая отражает самые первые существа, которые делились и, как предполагается, основывались на РНК – тонком, но гибком виде генетического материала, который не только хранит информацию, но, в отличие от ДНК, также может катализировать химические реакции. Действительно, рибосома – это рибозим, фермент, состоящий из РНК, свернутой в сложную структуру.
Загляните глубоко внутрь рибосомы, как это сделали структурные биологи, и вы увидите древнее ядро, которое превращало инструкции в белки для построения живых существ на протяжении большей части четырех миллиардов лет. Там вокруг центрального механизма РНК, чтобы отточить его работу, развилась белковая оболочка, различная в зависимости от существа: например, наши рибосомы почти в два раза больше, чем у насекомых, которые нас заражают.
Для работы рибосомы необходимы различные ингредиенты: во-первых, молекула матричной РНК, которая несет в себе инструкции по созданию белка из ДНК. Чтобы превратить этот код в белок, рибосома использует второй тип РНК – транспортную, которая несет в себе строительные блоки белков, называемые аминокислотами.
Сейчас мы знаем атомные детали того, как рибосома превращает данные ДНК в плоть и кости, благодаря получившим Нобелевскую премию рентгеновским исследованиям Венки Рамакришнана в Великобритании, Ады Йонат в Израиле и Томаса Стейца в США. Они обнаружили, что рибосома состоит из трех разных молекул РНК и более 50 различных белков, разделенных на два компонента (60S/40S в наших клетках и 50S/30S у бактерий). Один из них – «мозг», считывающий генетический код, а другой – большое «сердце», производящее белок (рис. 8). Они расходятся и объединяются по мере того, как молекулярные связи создаются и разрушаются, производя белки, которые строят тело и управляют им.
Конец ознакомительного фрагмента.
Текст предоставлен ООО «Литрес».
Прочитайте эту книгу целиком, купив полную легальную версию на Литрес.
Безопасно оплатить книгу можно банковской картой Visa, MasterCard, Maestro, со счета мобильного телефона, с платежного терминала, в салоне МТС или Связной, через PayPal, WebMoney, Яндекс.Деньги, QIWI Кошелек, бонусными картами или другим удобным Вам способом.
Примечания
1
Термин, обозначающий компьютерное моделирование (симуляцию) эксперимента, чаще биологического. Фраза была создана по аналогии с фразами in vivo (в живом организме) и in vitro (в пробирке).
2
YouTube. The virtual human project (posted March 12, 2018). https://www.youtube.com/watch?v=1ZrAaDsfBYY.
3
Grieves, M. & Vickers, J. Digital twin: Mitigating unpredictable, undesirable emergent behavior in complex systems. In Transdisciplinary Perspectives on Complex Systems (eds. Kahlen, J., Flumerfelt, S. & Alves, A.), 85–113 (Springer, 2017).
4
Shafto, M. et al. DRAFT Modeling, Simulation, Information Technology & Processing Roadmap, Technology Area 11 (NASA, 2010).
5
Negri, E., Fumagalli, L. & Macchi, M. A review of the roles of digital twin in CPS-based production systems. Procedia Manuf. 11, 939–948 (2017).
6
Niederer, S. A., Sacks, M. S., Girolami, M. & Willcox, K. Scaling digital twins from the artisanal to the industrial. Nat. Comput. Sci. 1, 313–320 (2021).
7
El Saddik, A. Digital twins: The convergence of multimedia technologies. IEEE Multimed.(2018). https://doi.org/10.1109/MMUL.2018.023121167.
8
Лерой Худ, интервью с Питером Ковени и Роджером Хайфилдом, 12 августа 2021 г.
9
Тим Палмер, электронное письмо Питеру Ковени, 2 июня 2021 г.
10
Bauer, P., Thorpe, A. & Brunet, G. The quiet revolution of numerical weather prediction. Nature 525, 47–55 (2015).
11
Abbe, C. The needs of meteorology. Science 1(7), 181–182 (1895).
12
Alley, R. B., Emanuel, K. A. & Zhang, F. Advances in weather prediction. Science 363, 342–344 (2019).
13
European Commission. Shaping Europe’s digital future: Destination Earth. https:// digital-strategy.ec.europa.eu/en/policies/destination-earth (accessed May 29, 2022).
14
Mitchell, H. H., Hamilton, T. S., Steggerda, F. R. & Bean, H. W. The chemical composition of the adult human body and its bearing on the biochemistry of growth. J. Biol. Chem. 158, 625–637 (1945).
15
Proctor, J., Hsiang, S., Burney, J., Burke, M. & Schlenker, W. Estimating global agricultural effects of geoengineering using volcanic eruptions. Nature (2018). https://doi.org/10.1038/s41586-018-0417-3.
16
Dallas, V. & Vassilicos, J. C. Rapid growth of cloud droplets by turbulence. Phys. Rev. E— Stat. Nonlinear, Soft Matter Phys. (2011). https://doi.org/10.1103/PhysRevE.84.046315.
17
Morton, O. The Planet Remade: How Geoengineering Could Change the World (Granta, 2015).
18
Auffray, C. & Noble, D. Origins of systems biology in William Harvey’s masterpiece on the movement of the heart and the blood in animals. Int. J. Mol. Sci. (2009). https://doi.org/10.3390/ijms10041658.
19
Noble, D. Claude Bernard, the first systems biologist, and the future of physiology. Exp. Physiol. (2008). https://doi.org/10.1113/expphysiol.2007.038695.
20
Nosil, P. et al. Natural selection and the predictability of evolution in Timema stick insects. Science (2018). https://doi.org/10.1126/science.aap9125.
21
Пол Нерс, интервью с Питером Ковени и Роджером Хайфилдом, 25 сентября 2021 г.
22
Nurse, P. Biology must generate ideas as well as data. Nature 597, 305 (2021).
23
Charlton, W. Greek philosophy and the concept of an academic discipline. Hist. Polit. Thought 6, 47–61 (1985).
24
Coveney, P. & Highfield, R. The Arrow of Time: A Voyage through Science to Solve Time’s Greatest Mystery (W. H. Allen, 1991).
25
Coveney, P. & Highfield, R. Frontiers of Complexity: The Search for Order in a Chaotic World (Faber, 1996).
26
Hunter, P., Robbins, P. & Noble, D. The IUPS human physiome project. Pflugers Archiv Eur. J. Physiol. (2002). https://doi.org/10.1007/s00424-002-0890-1.
27
Hernandez-Boussard, T. et al. Digital twins for predictive oncology will be a paradigm shift for precision cancer care. Nat. Med. 27, 2065–2066 (2021).
28
Hunter, P. et al. A vision and strategy for the virtual physiological human in 2010 and beyond. Philos. Trans. R. Soc. A Math. Phys. Eng. Sci. (2010). https://doi.org/10.1098/rsta.2010.0048.
29
Human Brain Project. The Human Brain Project: A Report to the European Commission. HBP-PS Consortium (2012).
30
Kitano, H. Grand challenges in systems physiology. Front. Physiol. 1, 3 (2010).
31
Хорхе Луис Борхес. Создатель (рассказы, стихотворения, интервью) / Пер. Б. В. Дубина. М.: Азбука-Аттикус, 2022.
32
Borges, J. L. On exactitude in science. Los Anales de Buenos Aires 1, 3 (March 1946).
33



