 Полная версия
Полная версияПолная версия:
Муковисцидоз: определение, диагностические критерии, терапия. Национальный консенсус
3.4. Диагностические критерии МВ
В диагностических критериях заболевания генетической диагностике отводится важная роль, однако диагноз может быть поставлен без данного исследования. Для подтверждения диагноза достаточно двух признаков, по одному из каждого блока:
1.1. Положительная потовая проба
и/или
1.2. Две патогенные мутации в гене CFTR в транс-положении, вызывающие муковисцидоз (http://cftr2.org, http://seqdb.med-gen.ru/)7
и
2.1. Неонатальная гипертрипсиногенемия
или
2.2. С рождения или появившиеся позже характерные клинические признаки, включая (но не ограничиваясь ими) такие, как диффузные бронхоэктазы, высев из мокроты значимой для МВ патогенной микрофлоры (особенно синегнойной палочки), экзокринная панкреатическая недостаточность, синдром потери солей, обструктивная азооспермия (мужчины) [20, 21, 22, 23].
3.4.1. Неопределенный диагноз при положительном неонатальном скрининге на МВ
Относительно недавно Европейское общество по муковисцидозу предложило выделять группу детей после неонатального скрининга с новым диагнозом: «неопределенный диагноз при положительном неонатальном скрининге на муковисцидоз» (CFSPID) – и выработало новые рекомендации для наблюдения за данной группой детей. В рекомендациях по муковисцидозу США (Cystic Fibrosis Foundation) для этой группы детей используется термин CFTR-зависимый метаболический синдром (CFTR-related metabolic syndrome, CRMS).
Рекомендовано после неонатального скрининга детей с положительным иммунореактивным трипсиногеном (ИРТ) без клинических проявлений заболевания разделять на две группы:
А – имеющие нормальные хлориды пота (<30 ммоль/л) и две мутации в гене CFTR, из которых, по крайней мере одна имеет «неясные» фенотипические последствия;
В – имеющие пограничные значения хлоридов пота и одну или ни одной мутации в гене CFTR.
Наблюдение за детьми с данным диагнозом осуществляется в центрах МВ. В возрасте 2 лет им рекомендовано проведение потовой пробы, так как у большинства из них к 3 годам могут появиться клинические симптомы МВ [24, 25].
3.4.2. ДНК-диагностика при CFTR-связанных нарушениях
Под CFTR-связанными нарушениями (CFTR-related disorders) принято понимать клинические состояния, ассоциированные с нарушением функции гена CFTR, но при этом не соответствующие полностью диагностическим критериям МВ [22, 23, 26].
К таким состояниям относятся двустороннее врожденное отсутствие семявыносящих протоков, рецидивирующий острый или хронический панкреатит, диссеминированные бронхоэктазы [23, 26].
Обязательным условием постановки диагноза является наличие хотя бы одной идентифицированной мутации в гене CFTR [22]. Однако клиническая практика показывает, что почти у 70–75% больных с диссеминированными бронхоэктазами диагностируется МВ и нередко больной с бесплодием при дообследовании оказывается больным МВ.
Высказано предположение, что в основе патофизиологических изменений при CFTR-связанных нарушениях лежит нарушение бикарбонатной проводимости канала CFTR. Канал CFTR осуществляет проведение не только ионов хлорида (Cl-), но и ионов бикарбоната (HCO3-). Экспериментально показано, что бикарбонатная проводимость канала CFTR повышается посредством WNK1-SPAK-активации [27]. Полное нарушение функции CFTR как хлорного канала при «тяжелых» мутациях приводит к клинической картине МВ. При таких генетических вариантах, как R74Q, R75Q, R117H, R170H, L967S, L997F, D1152H, S1235R, D1270N, проводящие свойства CFTR для хлоридов сохраняются. Однако наличие этих вариантов в молекуле CFTR нарушает активационный механизм WNK1-SPAK, что приводит к селективному нарушению функции CFTR как бикарбонатного канала. При этом поражаются органы, использующие, как полагают, CFTR для секреции бикарбоната, что повышает риск развития панкреатита, синусита и мужского бесплодия [27].
Генетические особенности врожденного двустороннего отсутствия семявыносящих протоков (ВДОСП; CBAVD)Около 3% случаев бесплодия у мужчин обусловлено наличием ВДОСП. Заболеваемость ВДОСП составляет приблизительно 1:1000 мужчин. Установлено, что в большинстве случаев изолированное ВДОСП является аутосомно-рецессивным генетическим расстройством, связанным с мутациями в гене CFTR с сохранением остаточной функции белка CFTR. Для ВДОСП характерно носительство в транс-положении одной «тяжелой» и одной «мягкой» мутации или двух «мягких» мутаций, а также «мягкой» мутации и мутации с неопределенной клинической значимостью или двух мутаций с неопределенной клинической значимостью [23].
У мужчин с ВДОСП в европейских популяциях наиболее распространенными являются два компаундных гетерозиготных генотипа: мутация F508del в транс-положении с вариантом IVS8-5T (28%) или с мутацией R117H (6%). Частота F508del при ВДОСП варьируется от 12 до 33%. Вариант IVS8-5T обнаружен во многих случаях ВДОСП даже в популяциях, где МВ встречается редко. Частота аллеля IVS8-5T у мужчин с ВДОСП составляет 25-40%, что в 5-8 раз выше, чем в общей популяции. Генотип, гомозиготный по этому аллелю, распространен при ВДОСП. Для ВДОСП характерно сочетание мутации R117H с аллелями IVS8-5T и IVS8-7T в цис-положении (комплексные аллели – R117H-5Т и R117H-7Т). Комплексный аллель R117H-5Т часто встречается у пациентов с МВ, в то время как аллель R117H-7Т, как правило, не связан с МВ. Повторы IVS8-TGn (IVS8-TG12 или TG13) в цис-положении с IVS8-5T также встречаются при ВДОСП. У пациентов с ВДОСП были обнаружены комплексные аллели: G576A-R668C, D443Y-G576A-R668C, R74W-V201M-D1270N и S1235R-IVS8-5T [23].
Ген CFTR и рецидивирующий (или хронический) панкреатитПанкреатит может быть обусловлен мутациями в ряде генов и встречаться как у людей без МВ, так и на его фоне. Мутации в гене CFTR встречаются у 32-48% больных хроническим панкреатитом с аутосомно-рецессивным типом наследования и у 10-15% больных МВ с сохранной функцией поджелудочной железы. Больные МВ с «мягкими» мутациями чаще имеют панкреатит.
Помимо мутаций в гене CFTR при панкреатите встречаются мутации в генах SPINK1 (ингибитор сериновой протеазы, тип Казал 1; serine protease inhibitor, Kazal type 1), PRSS1 (катионный трипсиноген), A1AT (α1-антитрипсин).
Предполагают возможность дигенного наследования панкреатита: часто у пациентов с панкреатитом обнаруживают гетерозиготное носительство мутаций в генах CFTR и PRSS1 или SPINK1 [28].
3.5. Генетический диагноз – фармакогенетическая терапия
Препараты, действие которых направлено на восстановление функции белка CFTR, называются CFTR-модуляторами и делятся на группы [29]:
• Корректоры CFTR: цель – увеличить количество и доставку белка CFTR к поверхности клетки.
• Потенциаторы CFTR: цель – увеличить активность ионного канала CFTR, расположенного на поверхности клетки.
• Препараты со свойствами модуляторов и потенциаторов.
• Вещества, способствующие «прочитыванию» стоп-кодонов CFTR-mRNA и предотвращению преждевременной терминации синтеза молекулы белка, используются при лечении пациентов, имеющих нонсенс-мутации (мутации I класса).
В связи с многообразием мутаций гена CFTR и различными их последствиями разработка этиотропной и патогенетической терапии, направленной на восстановление функции гена, изначально была сложной задачей и шла по нескольким направлениям:
1. Препараты для носителей мутаций класса I.
2. Препараты для носителей мутаций класса II и наиболее часто встречающейся мутации F508del.
3. Препараты для носителей «мягких» мутаций.
4. Препараты, работающие при всех классах мутаций.
В настоящее удалось добиться успеха при разработке препаратов, направленных на коррекцию последствий определенного вида мутаций II-V классов – потенциаторов и корректоров. Мишенью потенциаторов являются молекулы мутантного белка CFTR, располагающиеся в апикальной мембране. Действие потенциаторов направлено на восстановление (активацию) функции ионного канала, образованного мутантным белком CFTR (мутации III-IV классов). Первым препаратом стал Ивакафтор (Калидеко, VX-770) компании Vertex Pharmaceuticals Incorporated. Препарат получил одобрение FDA для лечения детей, больных МВ, старше 2 лет и взрослых, имеющих одну из 10 мутаций: G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N, S549R или R117H. Корректоры – лекарственные средства, позволяющие мутантному белку CFTR пройти через систему внутриклеточного контроля качества и занять правильное расположение на апикальной мембране (мутации II класса), – 4-фенилбутират/генистен; VX-809. Для терапии пациентов со II классом мутаций (генотип F508del/F508del) разработан комбинированный (корректор + потенциатор) препарат Оркамби (V809 и V770), он показан пациентам старше 6 лет. Идут исследования по снижению возрастных ограничений [7, 29].
Таким образом, разработанные препараты стали новым шагом в терапии МВ, повышении качества и продолжительности жизни больных. Исследования в области этиопатогенетической фармакотерапии МВ продолжаются (http://investors.vrtx.com; https://cysticfibrosisnewstoday.com/cystic-fibrosis-therapy-tracker/).
3.6. Другие гены, связанные с развитием МВ
У некоторых пациентов с МВ не удается выявить мутации в гене CFTR в обоих аллелях. Это наблюдается в 1-1,5% случаев при полной клинической картине заболевания.
Частично это может быть объяснено тем фактом, что в большинстве случаев проводится исследование лишь кодирующей части гена CFTR, и иногда также смежных экзон-интронных участков. Мутации, расположенные в регуляторных участках интронов и промоторных областях гена, в большинстве случаев не исследуются и не анализируются. Распространенность крупных структурных изменений гена (делеций и дупликаций) до настоящего времени также не изучена [2].
Необходимо упомянуть, что МВ характеризуется не только нарушением секреции хлоридов, но и повышенной абсорбцией натрия в дыхательных путях. Транспорт ионов натрия осуществляется через чувствительный к амилориду натриевый канал, состоящий из трех субъединиц. Известно, что повышенная экспрессия гена Scnn1b, кодирующего одну из субъединиц, приводит к развитию муковисцидозоподобного состояния в легких у мышей [31]. Это позволяет предположить, что нарушения гена SCNN1B могут вызывать заболевание и у людей. По крайней мере у двух пациентов с нетипичным МВ, у которых не идентифицированы мутации в кодирующей области гена CFTR, выявлены функционально значимые мутации в гене SCNN1B [32]. Генетические факторы, лежащие в основе других случаев МВ без мутаций в гене, остаются невыясненными [2].
Гены-модификаторыРазличия в характере течения заболевания у больных с одинаковым генотипом по гену CFTR наблюдаются как среди неродственных индивидов, так и между сибсами, испытывающими равное влияние таких средовых факторов, как условия проживания, социально-экономический статус, методы лечения. В мультицентровых исследованиях Европы и США выявлены достоверно более высокая конкордантность клинических проявлений (тяжесть бронхолегочного процесса, поражение печени, наличие в анамнезе мекониевого илеуса и синдрома дистальной интестинальной обструкции, нутритивный статус) у монозиготных близнецов по сравнению с дизиготными и просто сибсами, а также значительный диапазон вариабельности характера течения МВ внутри пар сибсов [7, 33]. Приведенные данные свидетельствуют о возможном влиянии на спектр и тяжесть клинических проявлений МВ других, в том числе генетических, факторов, отличных от гена CFTR. Модифицирующее действие могут оказывать как гены, продукты которых регулируют экспрессию, функцию и утилизацию белка СFTR, так и гены, продукты которых участвуют в процессах, задействованных в патогенезе клинических проявлений МВ.
В результате полногеномного анализа ассоциаций выявлены два кластера генов, расположенных в регионах хромосом 11p13 (гены APIP, EHF, ELF5, PDHX) и 20q13.2 (гены CBLN4, MC3R, CASS4, CSTF1, AURKA), модулирующих тяжесть поражения легких при МВ; показано, что гены SLC26A9, SLC6A14, SLC9A3, SLC4A4, MSRA, ADIPOR2 являются модификаторами мекониевого илеуса, а ген ARRDC3 – регулятором массы тела и энергозатрат у мужчин; для генов SLC26A9, CDKAL1, CDKN2A/B и IGF2BP2 показана ассоциация с МВ-зависимым диабетом [33].
В результате поиска генов-кандидатов выявлены ассоциации гена MNL2 со снижением функции легких при МВ, с ранним поражением P. aeruginosa и малой продолжительностью жизни; для генов TGFB1, IFRD1, IL-8, EDNRA показана ассоциация с тяжестью поражения легких; гены CAPN10, TCF7L2 ассоциированы с МВ-зависимым диабетом, а гены SERPINA1, SERPINA2 – с поражением печени при МВ (цирроз с портальной гипертензией) [33].
3.7. Частота и распределение мутаций
В постоянно обновляемой базе данных (http://www.genet.sickkids.on.ca/cftr) Консорциума по генетическому анализу МВ (CFGAC) представлено более 2000 вариантов нуклеотидной последовательности, выявленных в гене CFTR [1]. Только часть из них напрямую связана с развитием заболевания [15; http://seqdb.med-gen.ru/].
Наиболее распространенной мутацией гена CFTR является F508del, ранее обозначаемая как ΔF508. По имеющимся данным, ее частота составляет более 65% в объединенной мировой выборке обследованных больных МВ. В Европе наблюдается снижение частоты мутации F508del с северо-востока на юго-запад. Около 20-ти прочих мутаций встречаются в мировой выборке с частотой выше 0,1%. Распространенность отдельных мутаций может существенно варьироваться в конкретных регионах и популяциях, что является следствием эффекта дрейфа генов в различных религиозных, этнических или географических изолятах. В России наиболее частой мутацией также является F508del, составляющая около 52% от общего числа мутантных аллелей в объединенной выборке больных МВ. Ее частота варьируется от 40 до 60% в разных регионах. К настоящему времени у российских пациентов с МВ выявлено 155 различных мутантных аллелей гена CFTR (Табл. 1), большинство из которых являются весьма редкими [34]. Десять наиболее частых мутаций у российских больных составляют 71,22% от всех мутантных аллелей. Две мутации были определены у 70,4% от числа больных, у которых проводилось генетическое исследование, одна – у 23,1%, ни одной мутации не удалось выявить у 6,5% больных [34].
Таблица 1. Аллельная частота мутаций муковисцидоза в РФ (регистр 2015 г.)
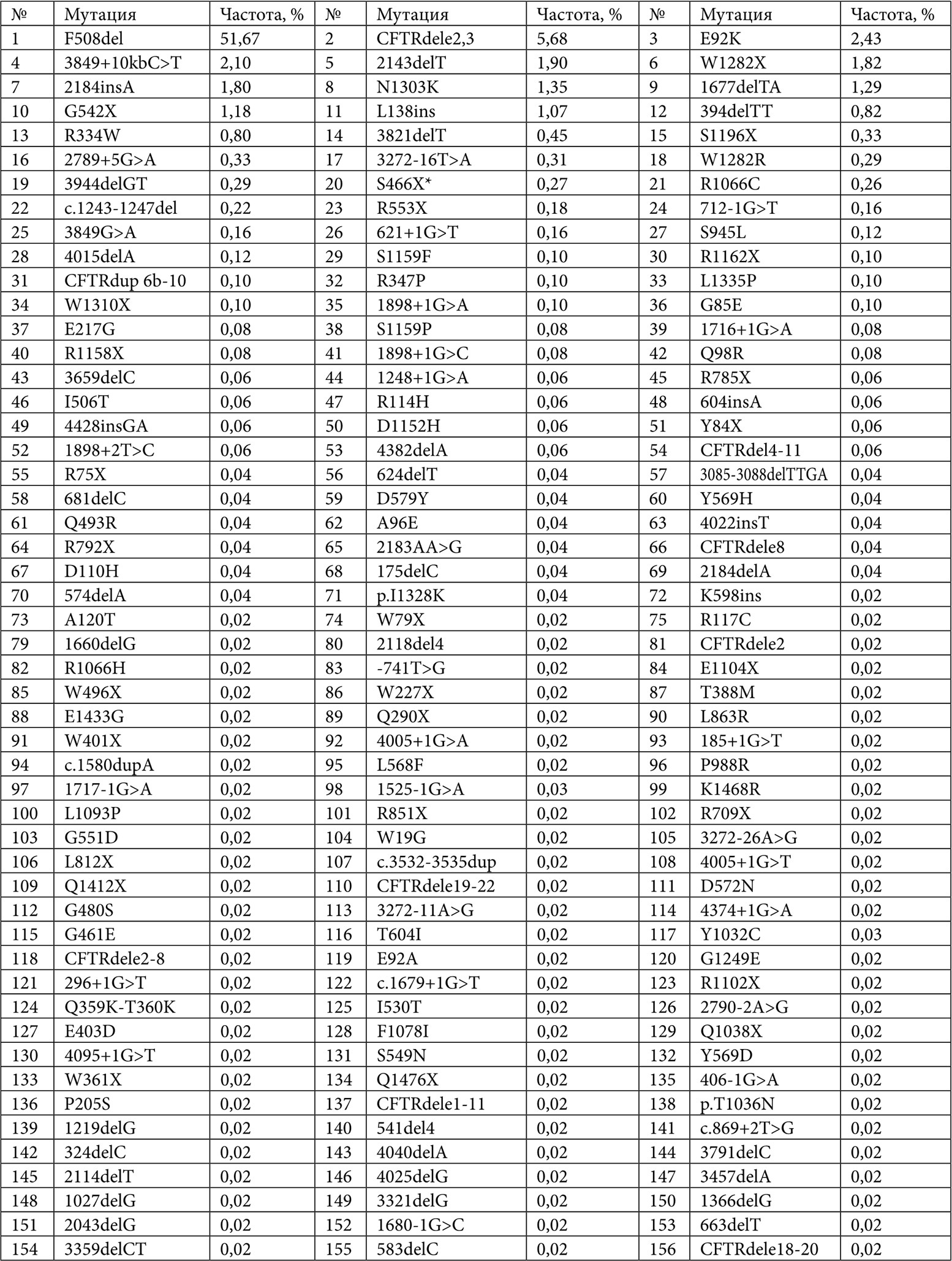
* Включая мутации S466X и S466X-R1070Q
Приведенные в Таблице 1 данные дают общее и несколько смещенное представление о разнообразии и частоте мутаций у российских пациентов с МВ, что связано с рядом особенностей проведения тестирования:
• ДНК-тестирование не является обязательным этапом при диагностике МВ, в том числе и в ходе неонатального скрининга в России, и выполняется по желанию родителей ребенка. Поэтому во многих регионах обследованы не все больные с установленным диагнозом;
• ДНК-тестирование большей части пациентов выполнялось на панелях, включающих ограниченный спектр мутаций (от 11–16 до 30 мутаций);
• в ряде случаев у пациентов с МВ не удается обнаружить двух мутаций, что может быть связано с их отсутствием в стандартных тест-системах, несовершенством алгоритмов ДНК-тестирования, существованием неизвестных ранее генетических вариантов, атипичных случаев МВ или МВ-подобных состояний, связанных с нарушением работы иных генов.
На основании сведений об эпидемиологической генетике МВ можно сделать следующие предположения:
• частота и спектр мутаций, ассоциированных с развитием МВ, варьируются в зависимости от региона проживания и этнической принадлежности обследуемых пациентов с МВ;
• отсутствуют репрезентативные сведения о спектре и частотах мутаций в гене CFTR для всей российской популяции и ряда регионов;
• для расчета вклада отдельных мутаций и их связи с развитием заболевания необходимо продолжить работу по созданию общероссийского регистра пациентов с МВ с внесением в него информации о результатах молекулярно-генетического тестирования всех диагностированных пациентов вне зависимости от формы проявления, возраста манифестации и региона проживания.
3.8. Этнические особенности спектра мутаций в гене CFTR у российских больных МВ
Спектр и относительные частоты мутаций гена CFTR могут существенно варьироваться не только в разных обследуемых регионах, но и в разных этнических группах. В регионах с преобладающим русским населением наиболее частыми являются мутации F508del (50-55%), CFTRdele2,3 (3,5-8,3%), 2143delT (1,1-3,8%), 2184insA (1,5-2,5%). Наименьшее значение относительной частоты мутации F508del отмечено в Северо-Кавказском ФО – 28,57%, но здесь высокую долю составляют мутации 1677delTA (18,75%), W1282X (16,07%) и E92K (2,68%). Мутация 1677delTA распространена среди автохтонных народов Кавказского региона. Так, у чеченских пациентов с МВ (34 индивида) ее доля составляет 66,2%, высока также доля мутации E92K (14,7%).
В недавно проведенной работе, в рамках которой исследованы больные МВ из Республики Чувашия [35], показано, что превалирующей по частоте мутацией у чувашских пациентов является мутация E92K, ранее обнаруживаемая в странах юго-восточного Средиземноморья, в частности в Турции [26, 36]. Мутация E92K обнаружена на 55,6% мутантных хромосом (20/36) у 18 обследованных чувашских пациентов, тогда как относительная доля мутации F508del составила 25% (9/36). Анализ здоровых индивидов показал, что гетерозиготным носителем мутации E92K является каждый 68-й житель Чувашии (5/343, т.е. 1:68), а мутации F508del – каждый 86-й [35]. Мутация E92K встречается у пациентов из разных популяций Волго-Уральского региона (Чувашия – 53,19%, Удмуртия – 6,76%, Татарстан – 2,38%, Башкирия – 1,37%, Самарская область – 3,06%, Пермский край – 0,75%, Оренбургская область – 1,96%), в Ханты-Мансийском АО (3,85%), а также во многих других регионах РФ [34]. Высокая доля мутации E92K у чувашей, вероятно, объясняется эффектом основателя и прохождением популяции чувашей через «бутылочное горлышко» в XIV веке.
Мутация W1282X встречается в разных регионах мира. Предполагают, что мутация W1282X произошла в результате единичного мутационного события в популяции ближневосточных евреев до их переселения в Европу. Наибольшей величины ее частота достигает в популяции евреев-ашкенази Израиля (до 50% мутантных аллелей у больных с МВ). Распространение мутации W1282X в других регионах Европы и мира связывают с расселением евреев-ашкенази. Относительно высокая доля этой мутации наблюдается в регионах с высоким уровнем урбанистического населения. Аналогичную тенденцию можно наблюдать и в России: в Москве – 2,93%, Смоленске – 2,94%, Новосибирске – 2,56%, Кемеровской области – 2,17% [34]. Интересным фактом является недавно обнаруженная высокая доля мутации W1282X у больных МВ карачаевцев (18 из 20 аллелей, 90%). Частота мутации W1282X в выборке здоровых карачаевцев из Карачаево-Черкесии составила 1,8% (6/660 хромосом). Проникновение мутации W1282X на Восточный Кавказ можно связать с миграцией евреев из Византии через северное Причерноморье или Грузию в раннем средневековье, или через Персию, или Иран в позднем средневековье. Высокую долю мутации W1282X в этой популяции можно объяснить эффектом основателя [37]. Кроме «урбанистической» привязанности также очевиден вектор распространения мутации W1282X с юга на север – с максимальной концентрацией в кавказских республиках (в частности, в Карачаево-Черкесии) и минимальной встречаемостью в регионах севернее Москвы.
Мутацию 394delTT называют «нордической» («северной»): она распространена с высокой частотой в странах, расположенных по побережью Балтийского моря и вдоль связанных с ним речных путей (в Швеции, Норвегии, Дании, Финляндии, Эстонии, России и т.д.). В России эта мутация обнаружена также в регионах проживания тюркоязычных народов, в этногенезе которых прослеживается угро-финский элемент (Татарстан – 1,59%, Башкирия – 1,37%, Нижегородская обл. – 1,41%, Оренбургская обл. – 1,96%, Самарская обл. – 1,02%) [34].
Мутация 1677delTA, впервые обнаруженная у грузинских пациентов [26, 38], распространена на Кавказе у людей, относящихся и к другим этническим группам: у чеченцев, ингушей, армян и др. (см. Табл. 2).
В небольшой группе пациентов из Дагестана неоднократно выявлены мутации: A96E, S1159F, R1066C, 1248+1G>A (последняя мутация также однократно встретилась у осетина).
Таблица 2. Спектр мутаций в гене CFTR в этнических группах российских больных муковисцидозом
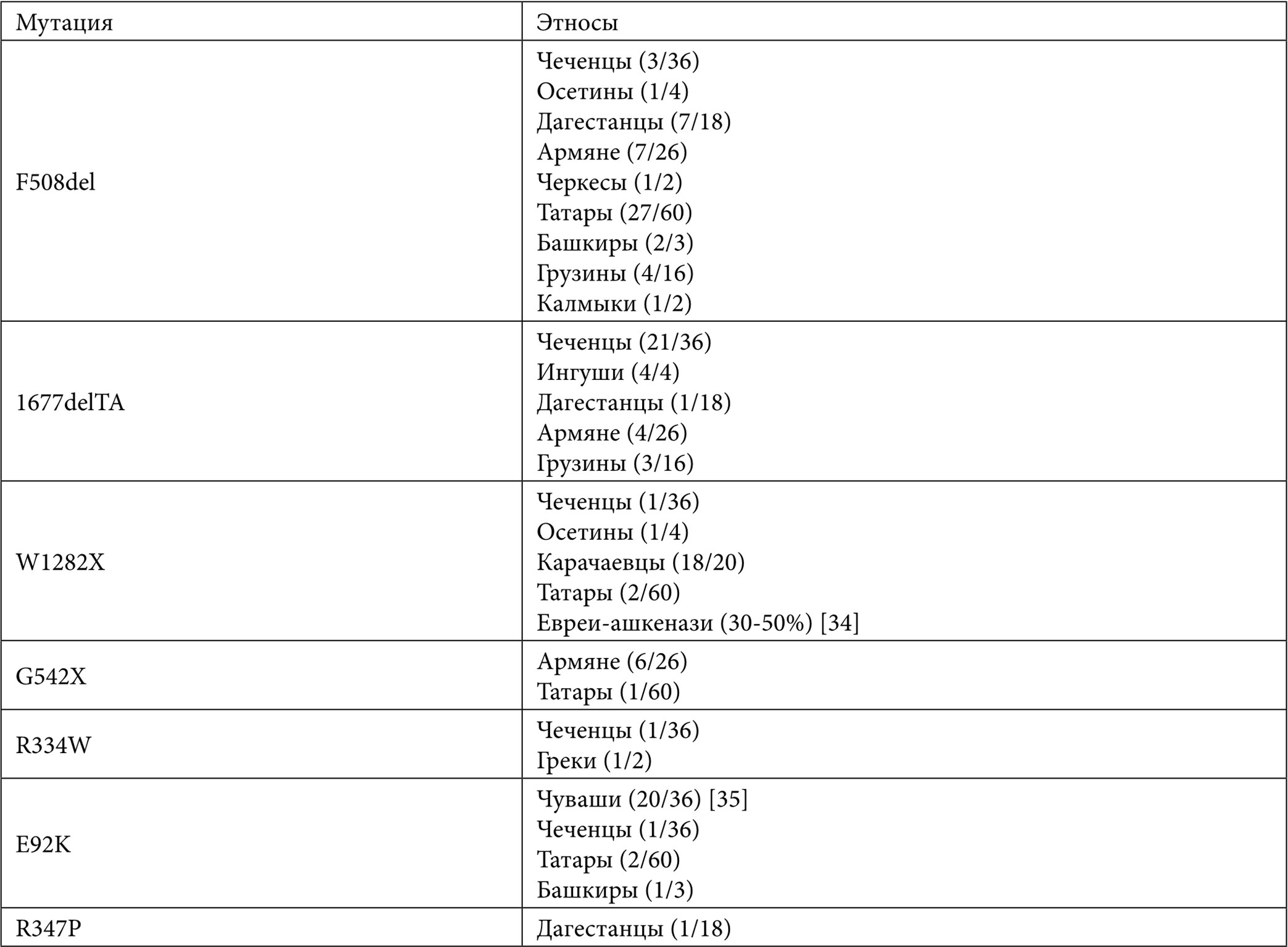

1 – [34]; 2 – [35]
В НИИ медицинской генетики, Томский НИМЦ (г. Томск), систематически проводится анализ спектра мутаций гена CFTR у больных МВ из Сибирского региона (среди обследованных пациентов преобладают русские). Помимо основного, наиболее частого, генного дефекта F508del, следующие мутации выявляются с частотой >4%: CFTRdele2,3, E92K, 2184insA, R1066C; с частотой >2%: G542X, 3849+10kbC>T, R1162X, 2143delT, L138ins, E217G и функционально значимый вариант 5T (IVS8-5T); с частотой ~1%: 2184delA, 394delTT, W1282X, N1303K, R347P, R553X, 3821delT, R117C, Y569C, 3791delC, 2789+5G>A, L1335P, 4015delA, 4040delA, W1310X, R1158X, 1898+1G>C, 1898+1G>A, 1898+2T>C, S1196X, G228R, Q98R, 3944delGT, I148T, 4382delA и крупные внутригенные делеции/ дупликации. Охарактеризованы мутации у представителей коренных народностей Сибири (буряты, хакасы, тувинцы, алтайцы). Спектр определенных у них мутаций: F508del, c.650A>G (E217G), R1066C, R1162X, c.293A>G (Q98R), c.682G>C (G228R); две последние – новые мутации [39].
3.9. Подход к генетическому тестированию
По рекомендациям Европейского консенсуса по МВ [2], для обеспечения высокой эффективности диагностический метод должен обеспечивать выявление по крайней мере одной клинически значимой мутации в гене CFTR не менее чем у 90% больных МВ. При ДНК-диагностике необходимо обеспечивать качественное и достоверное обнаружение генетических вариантов в исследуемой популяции/регионе. Использование в ходе тестирования ограниченного набора мутаций может привести к возникновению ряда проблем, связанных с невысокой диагностической чувствительностью такого подхода в генетически гетерогенных популяциях, и необходимости разработки специфических диагностических панелей, включающих расширенный спектр мутаций.
Для обеспечения достоверности результатов проводимых исследований следует разработать алгоритм и стандарты проведения молекулярно-генетического тестирования и использовать лишь те диагностические методы и наборы реагентов, которые прошли необходимые клинические испытания и имеют подтвержденные в рамках тестирования на достоверной выборке образцов из российской популяции диагностические и аналитические характеристики.
Также необходимо отметить важность создания и ведения регистра пациентов с МВ с обязательным внесением в него информации об определенном генотипе в целях разработки более оптимальных диагностических панелей для конкретных регионов.
3.9.1. Панели мутаций гена CFTR, используемые в Российской Федерации
1. CFTRdele2,3, G85E, 394delTT, R117H, E92K, A96E, L138ins, 604insA, 621+1G>T, R334W, R347P, S466X (TGA), I507del, F508del, 1677delTA, 1717-1G>A,G542X, G551D, R553X, 2143delT, 2183AA>G, 2184insA, 2789+5G>A, 3272-16T>A, S1159P(F), S1196X, 3667insTCAA, 3821delT, 3849+10kbC>T, W1282X, W1282R, 3944delGT, N1303K – лаборатория генетической эпидемиологии ФГБНУ «МГНЦ» (www.med-gen.ru) [35, 36, 37, 38, 41, 42, 43, 44, 45, 46].
2. F508del, I507del, 1677delTA, CFTRdele2,3, E92K, 3849+10kbC>T, R334W, R347P, G551D, R553X, G542X, 2143delT, 2184insA, 394delTT, 306delTAGA, 3821delT, L138ins, N1303K, W1282X, 3944delGT, 2176insC, 2183delAA, 2183AA>G и коммерческий набор «Elucigene CFEU2v1» (фирма Gen-Probe, США) на 50 частых европейских мутаций – НИИ медицинской генетики, Томский НИМЦ (www. medgenetics.ru) [39].
3. CFTRdele2,3, G85E, 394delTT, R117H, E92K, E92X, L138ins, 621+1G>T, R334W, R347P, S466X, I507del, F508del, 1677delTA, 1898+1G>C, G542X, G551D, R553X, L581X, 2143delT, 2183delAA, 2183AA>G, 2184insA, S945L, R1066C, S1159P, R1162L, L1335P, R1162X, S1196X, 3849+10kbC>T, W1282X, W1282R, N1303K – НИИ акушерства и гинекологии им. Д.О. Отта СЗО РАМН, СПб. [48].



