
Полная версия:
Исследование эффективности современных нанокатализаторов

Исследование эффективности современных нанокатализаторов
Чжан Лянцзы
© Чжан Лянцзы, 2022
ISBN 978-5-0059-1263-3
Создано в интеллектуальной издательской системе Ridero
ВВЕДЕНИЕ
Попутный нефтяной газ (ПНГ) – это ценнейшее химическое сырье и высокоэффективное органическое топливо. Попутный газ, помимо метана, содержит значительное количество этана, пропана, бутана и других предельных углеводородов, а также не углеводородных компонентов.
Исторически сложилось, что внимание общественности, контролирующих органов привлекают, главным образом, разливы нефти с последующим загрязнением земельных ресурсов и водных объектов. При этом часто не уделяется должного внимания выбросам в атмосферу и другим негативным последствиям сжигания попутного газа на факелах. В то же время, поступающие в окружающую среду продукты сгорания попутного нефтяного газа представляют собой потенциальную угрозу нормальному функционированию человеческого организма на физиологическом уровне. Для эффективного использования ПНГ
Актуальность данной работы определяется необходимостью получения большого объема метанола для химической промышленности, потребностью изучения научной проблемы разработки нанокатализаторов на основе железа/цеолита для повышения выхода метанола в реакции преобразования метана из ПНГ.
Метанол является экономически выгодным продуктом химической реакции преобразования синтез-газа и распространенным соединением, применяющимся в разных отраслях промышленности. В нефтегазовой промышленности метанол используется для: очистки топлива, борьбы с гидратообразованием, увеличения октанового числа, производства изопрена и метилтретбутилового эфира (МТБЭ), производства биодизельного горючего.
С развитием нанотехнологии появился новый доступ к решению вопроса о полезном использовании ПНГ. Замечательными способностями обладают наноразмерные катализаторы. Благодаря их активности наночастиц катализаторы обладают ускорением реакции в сотни раз.
СОВРЕМЕННОЕ СОСТОЯНИЕ И ПЕРСПЕКТИВЫ РАЗВИТИЯ ТЕХНОЛОГИЙ ИСПОЛЬЗОВАНИЯ ПОПУТНОГО НЕФТЯНОГО ГАЗА
Состояние разработки попутного нефтяного газа
Попутный нефтяной газ является смесей газов и парообразных углеводородных и не углеводородных компонентов природного происхождения, которые выделяются из скважин и из пластовой нефти при ее сепарации [1]. Количество газа в нефти обычно колеблется в довольно широких пределах, достигая от одного кубометра до нескольких тысяч в одной тонне нефти. Он представляет собой ценный сопутствующий продукт [2—5].
Ниже представим некоторые составы ПНГ в месторождении Чанцин (Китай) [6—8]. Как правило, в зависимости от района добычи вместе с 1 т сырой нефти получают от 25 до 800 м3 такого газа. Содержание газа до 200 м3 на 1 т нефти считается низким, 400—600 м3 – высоким. В ряде случаев добыча нефти производится при аномально высоком содержании газообразных продуктов – до 2,5 тыс. м3 на 1 т нефти.
Известно, что ПНГ обладает высокой теплотворной способностью, уровень которой находится в диапазоне 9—15 тысяч Ккал/м3. Калорийность ПНГ составляет 1,46 МДж/м3. Таким образом, он может эффективно использоваться в энергетике [9—10]. ПНГ в основном составляет метан, этан, пропан, бутан и изобутан и содержит в высокомолекулярной жидкости. В нем также содержится примеси различного состава и фазы. Метан занимает примерно 61,74%, этан – 7,71%, пропан – 17,59%, бутан – 4,87%, изобутан – 3,76%, а азот – 1,34% [11].
В зависимости от этого их можно условно разделить на три категории [5]:
1. Бедные или сухие, содержащие до 50 г/м3 тяжелых углеводородов;
2. Средней жирности, содержащие от 50 до 400 г/м3 тяжелых углеводородов;
3. Жирные содержащие свыше 400 г/м3 тяжелых углеводородов.
Большинство попутных газов может быть отнесено к категории жирных. С легкой нефтью добывают более жирный газ, с тяжелой нефтью- преимущественно сухой газ [12].
Содержание углеводородов СЗ+ может изменяться в диапазоне от 100 до 600 г/м³. При этом состав и количество ПНГ не является величиной постоянной. Возможны как сезонные, так и разовые колебания (нормальное изменение значений до 15%).
Пропан и бутан легко могут сжижаться при обычной температуре даже при небольших давлениях.
В связи с этим в пластовых условиях распределение каждого углеводорода между жидкой и газообразной фазами будет находиться в соответствии с давлением паров при данной температуре. Газ, не перешедший в жидкую фазу в пластовых условиях, может находиться в разных состояниях в разных состояниях в зависимости от давления насыщения (свободном, растворенном, адсорбированном и др.).
Плотность при 0 ℃ примерно 0,7—1,2 кг/м3. Низшая теплота сгорания примерно 36,9—52,4 МДж/нм3. Число Воббе примерно 47,8—55,0 МДж/нм3.
Получение ПНГ часто пользуют метод сепарирования от нефти в многоступенчатых сепараторах. Давление в различных сепараторах обычно отличается велико. Например, в сепараторе первой ступени величина является 1600—3000 кПа, а на последней величина не превышает 150—400 кПа. Давление и температура конструируется в процессе сепарирования смеси газ – нефть – вода, получаемой со скважины.
Специфической особенностью ПНГ является обычно незначительный расход получаемого газа, от 100 до 5000 нм³/час.
Пользование ПНГ отличается от природного, потому что по составу природный газ содержат более 95% метана. А в ПНГ более содержат углеводород С3+. С увеличением содержания углеводород С3+ более ценности возвращает ПНГ.
Однако успешному использованию в экономике попутного нефтяного газа мешают два фактора. Во-первых, это нестабильность его состава и наличие большого количества примесей, а во-вторых, необходимость существенных затрат на его «осушку». Дело в том, что нефтяной газ обладает уровнем влагосодержания, равным 100% [13—15].
Технология и механизм получения метанола из метана
Технологическое получение метанола
Метанол (CH3OH) – это химическое вещество с самой простой структурой в спиртах. Как и большинство химических веществ, содержащих гидроксильные группы, это бесцветная жидкость при комнатной температуре, летучая и имеет резкий запах. Он полностью смешивается с водой, растворяется в спиртах и эфирах. Большинство из них. другие органические растворители. При низких температурах метанол обладает высокой способностью абсорбировать такие кислые газы, как диоксид углерода, сероводород и карбонилсульфид. Это особое физическое свойство позволяет использовать метанол в качестве растворителя для десульфуризации и декарбонизации промышленных газов [16—18].
Метанол имеет метильную группу и гидроксильную группу в своей молекулярной структуре. Он химически активен и может подвергаться окислению, конденсации, дегидратации, метилированию и другим реакциям. Таким образом, метанол можно использовать для получения химического сырья, такого как формальдегид, уксусная кислота, метиламин, диметиловый эфир и метилформиат [19—20].
Метанол легко сжигается, при сгорании выделяется вода и CO2, а также выделяется большое количество тепла.
Преимущества низкого содержания углерода, высокого октанового числа, большого объема производства объем и удобная транспортировка позволяют использовать метанол в качестве топлива. Этот вид экологически чистой энергии используется в автомобильной промышленности. В марте 2019 года в «Руководящих заключениях по применению автомобилей на метаноле в определенных регионах» упоминалось [22], что для реализации диверсификация энергии транспортных средств, применение транспортных средств на метаноле должно быть ускорено. В качестве энергоносителя топливный элемент с протонообменной мембраной, использующий метанол в качестве топлива, обладает преимуществами низких выбросов углерода, высокой плотности энергии и легкого доступа к сырью. По сравнению с метанолом в качестве прямого топлива топливный элемент с высвобождением энергии имеет более высокий уровень преобразования энергии. По сравнению с существующей аккумуляторной батареей топливный элемент пропускает операцию зарядки, и получение энергии происходит проще и быстрее [23—25].
Объемная плотность энергии водорода чрезвычайно мала, а вода, получаемая при высвобождении энергии, чрезвычайно чиста. Это идеальный источник энергии [26]. Однако затраты на хранение и транспортировку водорода огромны. Содержание водорода и углерода в метаноле относительно велико, который является очень подходящим носителем водородной энергии. Зарубежное промышленное производство водорода в основном использует катализатор парового риформинга метанола, и эта технология является относительно зрелой [27,28].
Независимо от того, идет ли речь в направлении химической промышленности или энергетики, постепенная замена нефти возобновляемым метанолом имеет большое значение для смягчения энергетического кризиса.
На мировом рынке по производству метанола в 2019 г. составило 89,2 млн т. и по данным показано в России произвели 4,46 млн т метанола. В Китае по новейшим данным эта цифра составляет 59,21 млн т [29].
Из метана составляет два типа синтеза: метод в 2 стадии и метод во одну стадию. По методу в 2 стадии сначала неполно окисляется метан и получается синтез-газ (оксид углерода и водород). После получения их синтезируется метанол. Реакция показывает ниже:
CH4 + H2O = CO +3H2 CO + H2 = CH3OH
В настоящее время получение метанола из метана принимается метод в 2 стадии по всему миру.
Промышленно в этом методе паровой риформинг метана на катализаторе Ni/ -Al2O3, нагретом до 1173 К, происходит в первичном реакторе. Затем непрореагировавший метан подвергается риформингу с кислородом и паром во вторичном реакторе, образуя смесь CO и H2 в равновесии (рис. 1.1).
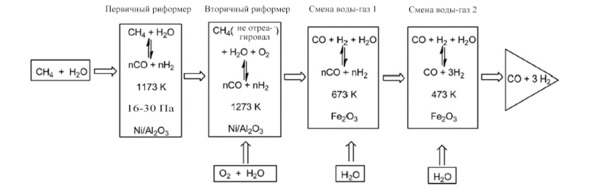
Рис. 1.1. Производство синтез-газа путем традиционного парового риформинга метана [30]
Затем на следующих двух этапах пар добавляется к синтезу-газу, полученному при более мягкой термической обработке, чем раньше (около 673 К), через оксид железа или медные катализаторы. На протяжении этих стадий конверсии водяного газа добавление пара может затем регулировать молярное соотношение H2: CO до необходимого для дальнейшего использования синтез-газа. В целом синтез-газ стехиометрия направлена на его использование в качестве сырья для синтеза дизельного топлива с помощью процесса Фишера-Тропша (катализатор Fe2O3) или синтеза метанола (катализатор Cu – ZnO / Al2O3) [31—33]. Хотя это не показано, в этих условиях реакции образуется кокс, что приводит к дезактивации катализатора. Использование никеля, нанесенного на оксиды редкоземельных элементов или щелочных металлов, сводит к минимуму эту нежелательную реакцию и увеличивает срок службы катализатора, ограничивающего углеродные отложения.
В качестве альтернативы метан можно преобразовать с помощью смеси пара и кислорода, нагретой до высокой температуры (около 2273 К) без катализатора. Эти условия способствуют радикальной реакции, обычно называемой «гомогенное окисление» (рис. 1.2).
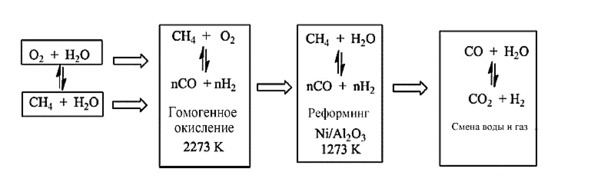
Рис. 1.2. Производство синтез-газа методом автотермического риформинга метана [32]
Следующая стадия происходит в другом реакторе, где полученную смесь затем реформируют на никелевых катализаторах, в результате чего получают синтез-газ и воду, которые можно обрабатывать в условиях реакции конверсии водяного газа. Потом идет основная реакция для получения метанола.
Затем представляем 2 процесса производства метанола из метана.
Процесс BASF (называемый «процесс высокого давления») превращает синтез-газ в метанол на катализаторах ZnO – Cr2O3, работающих при высоком давлении (от 250 до 350 бар) и в диапазоне температур от 573 до 673 К, толерантный к сере, яду, присутствующему в больших количествах в сланцевом газе, который широко использовался в начале двадцатого века [34].
Процесс BASF использует жесткие условия реакции для производства метанола. По этой причине несколько исследователей интенсивно работали над достижением более мягких условий реакции. В течение первых тридцати лет прошлого века катализаторы из оксида меди позволили снизить температуру и давление процесса BASF. Однако медные катализаторы обладают высокой чувствительностью к отравлению серой.
Imperial Chemical Industries, Ltd. (ICI) разработала системы очистки синтез-газа. Они обнаружили, что катализатор Cu – ZnO был намного активнее, чем ZnO – Cr2O3, хотя первый продолжал легко отравляться серой [35]. Разработка эффективных систем очистки и активных катализаторов привела к тому, что в настоящее время используется процесс, который работает на катализаторе Cu – ZnO / Al2O3 для преобразования «метгаза» (т.е. синтез-газа с адекватным молярным соотношением между CO и H2) в метанол под давлением 50 до 100 бар и температур в диапазоне от 513 до 533 К. (рис. 1. 3).
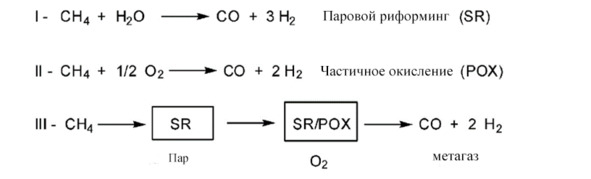
Рис. 1.43 Паровой риформинг метана в сочетании с синтезом метгаза [36]
В данной момент разрывается метод с пользованием катализатором Cu—Zn/Al2O3. Этот процесс был первым коммерческим способом производства метанола из синтез-газа при низком давлении.
Первоначально считалось, что активные центры составляют частицы Cu (0). Исследование показало, что другие фазы также играют важную роль в активности и сроке службы катализатора. Действительно, Ноннеман и Понек продемонстрировали, что чистая Cu является неактивным катализатором синтеза метанола. Они пришли к выводу, что ионы Cu (I) образуются на протяжении всего процесса и стабилизируются промоторами (т.e. ZnO, CsCO3) на поверхности Cu (0), которая поставляется адсорбированными атомами водорода [20, 37—39].
Обширные исследования были посвящены прямому окислению метана в метанол, которое включает следующие технологии:
– гомогенные процессы без катализатора при высоких температурах, основанные на радикальных реакциях в газовой фазе;
– процессы с твердым катализом в газовой фазе;
– процессы с твердым катализатором в жидкой фазе;
– гомогенно-каталитические процессы в жидкой фазе в присутствии растворимых катализаторов;
– ферментативные каталитические процессы.
Главной проблемой считается в этом процессе сильная сигма связь C— H. Метанол легче окислить до стабильных продуктов чрезмерного окисления (например, CO или CO2), чем окислить сам метан. Становится трудным контролировать селективность одностадийного процесса окисления метана до метанола.
Обоснование реакции получения метанола
Поскольку атомы в молекуле метана образуют четыре эквивалентных связи CH с четырьмя атомами, образуя симметричную правильную тетраэдрическую структуру, энергия диссоциации связи CH3-H достигает 435,43 кДж / моль и не приносит пользы другим веществам [40]. Функциональные группы, магнитные свойства, полярность и т. д. стали серьезной проблемой при каталитическом окислении метана до кислородсодержащих соединений. Более того, большинство кислородсодержащих соединений метана не так стабильны, как метан, и легко дополнительно окисляются до диоксида углерода в процессе окисления метана, что делает целевой продукт реакции окисления менее селективным.
Согласно соответствующим результатам термодинамических расчетов, частичное окисление метана до метанола или формальдегида является термодинамически допустимым, например:

Но когда метан и кислород нагреваются до температуры выше 500° C, в продукте остается лишь небольшое количество метанола и формальдегида, которые в основном являются продуктами полного окисления.
В 2019 г. была обнаружена реакция с пероксидом водорода. Реакция в ниже указывают:
CH4 + H2O2 = CH3OH + H2O
В реакции использовали катализатор FeOOH/m-WO3、 (рис. 1.4.).
Катализатор в этих процессах играют важную роль: во-первых, катализаторы помогают реакцию снижением энергии активации, чтобы ускорила реакция; во-вторых, катализаторы помогают ввести реакции, чтобы получили подходящие продукции.
Для понимания и создания катализаторов требуется знание механизма катализатор во процессе. Так как в последние годы ученые испытали искать как добраться от метана до метанола и достигли своих достижений по-разному.
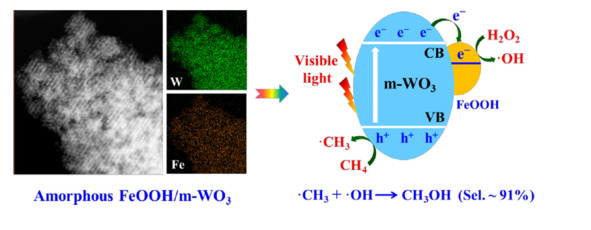
Рис. 1.4. Схема реакции метана с пероксидом водорода [41]
В последних трех годах ученые исследуют катализатор Cu-ZSM-5/цеолит и узнали его механизм действия с молекулами метана. Китайские ученые от Ланьчжоуского университета и института физической химии при КАН обнаружили процесс действия на основе результатов ЭПР и ЯМР [43]. На основании наблюдений ЭПР и ЯМР в твердом состоянии они предложили механизм селективного прямого окисления метана в метанол на цеолите Cu / Na-ZSM-5 (рис. 1.5), который включает три основных этапа:
а) активация метана на [Cu2O] 2+ ядро из цеолита Cu / Na-ZSM-5 и генерирует метанол, а Cu2+ восстанавливается до Cu+;
б) адсорбированный метанол активируется на частицах Cu+, образуя метокси-группы меди (—Cu – O—CH3) и группу —Al – OH;
в) свободный метанол образуется в результате гидратации метокси-групп меди и вытеснения адсорбированного метанола.
Сообщался о механизме высокоселективного превращения метана в метанол на модифицированном медью цеолите Cu / Na – ZSM-5 при температуре 423 K. Исследование ЭПР показывает, что восстановление ионов Cu2+ до иона Cu+ происходило во время превращения. метана в метанол на цеолите Cu / Na – ZSM-5.
Кроме этого, другой доступ обнаружен для получения метанола с помощью катализатора Rh1/ZrO2.
Данные спин-улавливания ЭПР in situ демонстрируют, что радикал •CH3 и радикал •OH образуются в процессе метана-метанола на цеолите Cu / Na – ZSM-5. ЯМР-исследование в твердом состоянии подтверждает, что метокси-группы меди и адсорбированный метанол образуются на цеолите Cu / Na-ZSM-5 после активации метана при 423 К.
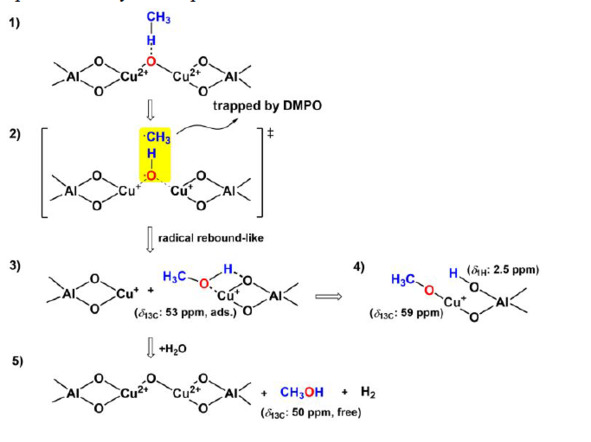
Рис. 1.5. Предложенный механизм превращения метана в метанол на цеолите Cu / Na – ZSM-5 [43]
При гидратации поверхностные метокси-частицы и адсорбированный метанол переходят в свободный метанол. Результаты показывают эволюцию активных центров и образование метоксидов меди и адсорбированного метанола при активации метана на цеолите Cu / Na – ZSM-5. Ожидается, что наше механистическое понимание процесса превращения метана в метанол на цеолите Cu / Na – ZSM-5 может потенциально пролить свет на окисление CH4 в pMMO и рациональный дизайн биомиметических каталитических систем.
Как показано на рисунке 1.6., CH4 слабо адсорбируется с энергией адсорбции -0,14 эВ, а затем реагирует с O, соседним с пятикоординированным Rh, с образованием промежуточного соединения CH3O* и OH* с относительно низким барьером 0,67 эВ, что указывает на О соседний пятикоординированный Rh обладает относительно высокой активностью по активации CH4.
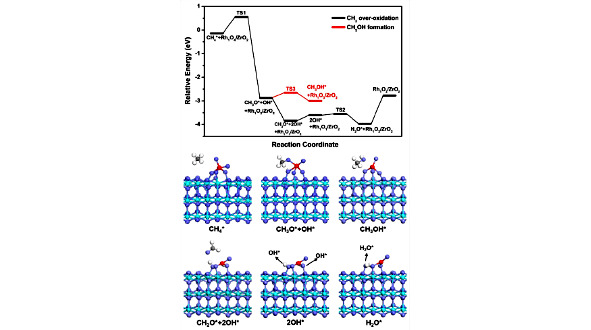
Рис. 1.6. Энергетические профили и структуры активации CH4 и переокисления CH3 при пятикоординированном Rh в Rh1O4 / ZrO2 (101): голубые, фиолетовые, красные, серые и белые шары представляют атомы Zr, O, Rh, C и H соответственно [44]
Однако образовавшиеся частицы CH3O нестабильны и самопроизвольно подвергаются дальнейшему дегидрированию с образованием CH2O без энергетического барьера. При этом образование CH3OH по реакции между CH3O и соседним H имеет энергетический барьер 0,32 эВ.
Эти результаты показывают, что промежуточный CH3O, образованный при пятикоординированном Rh, не может стабильно существовать, что можно объяснить сильным взаимодействием между частицами CH3O и соседними с Rh атомами O. Стабильные виды CH3 играют ключевую роль в образовании метанола. Следовательно, пятикоординированная структура Rh не должна быть активным центром образования метанола из-за переокисления частиц СН3, хотя она имеет относительно низкий энергетический барьер для активации СН4. Образовавшиеся виды CH2O слабо связываются с поверхностью. Десорбция CH2O требует низкой энергии 0,23 эВ, что указывает на то, что десорбция CH2O довольно проста. Затем через перенос H образуется H2O, а десорбция H2O приводит к образованию трехкоординированной структуры Rh1O2 / ZrO2.
Впоследствии H2O2 адсорбируется на границе раздела Rh1O2-ZrO2 с энергией адсорбции -0,97 эВ (рис. 1.7). Адсорбированные H2O2 и Rh-O синергетически активируют CH4, приводя к образованию частиц CH3O и H2O. Расчетный активационный барьер для диссоциации CH4 составляет 1,87 эВ, что выше, чем (1,23 эВ), о котором сообщалось в предыдущем исследовании. Это можно объяснить различными расчетными структурами. В исследовании авторы рассматривали легированную Rh структуру ZrO2, в которой один поверхностный атом Zr на поверхности ZrO2 (101) замещен атомом Rh. Они обнаружили, что H2O2 может самопроизвольно диссоциировать на частицы O2* и 2H* на поверхности ZrO2 (101), легированной Rh, а диссоциированные поверхностные частицы O2* действуют в качестве активного центра диссоциации CH4 с энергетическим барьером 1,23 эВ. Напротив, в нашем исследовании мы рассчитали модель Rh, поддерживаемую ZrO2, в которой один атом Rh поддерживается на поверхности ZrO2 (101). Мы обнаружили, что H2O2 не может спонтанно диссоциировать на O2* и 2H* на Rh, поддерживаемом ZrO2. Таким образом, разный активный сайт приводит к разной энергии активации.
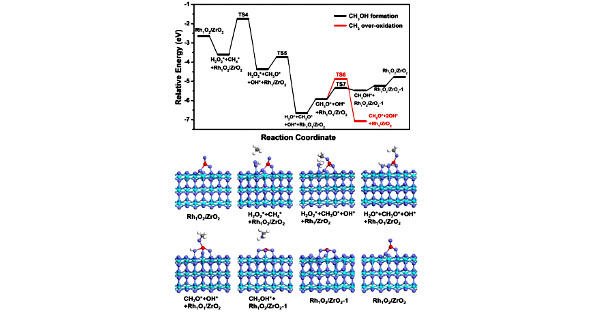
Рис. 1.7. Энергетические профили и структуры образования стабильных видов CH3. Голубые, фиолетовые, красные, серые и белые шары представляют атомы Zr, O, Rh, C и H соответственно [44]
Затем десорбция H2O приводит к образованию четырех-координированной структуры Rh-O, и частицы CH3O почти перпендикулярны поверхности, как показано на рисунке 1.9. Чтобы определить, является ли эта сформированная разновидность CH3O стабильной или продолжает подвергаться дегидрированию, они рассчитал процесс дегидрирования CH3O.
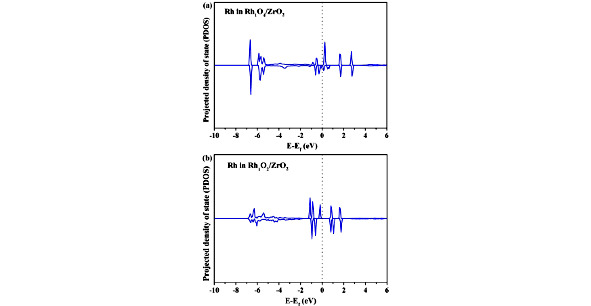
Рис. 1.9. Сравнение плотности состояний (DOS) для Rh в (a) Rh1O4 / ZrO2 (101) и (b) Rh1O2 / ZrO2 (101) [44]
Энергетический барьер этого процесса был рассчитан на уровне 1,06 эВ, что почти в два раза больше, чем для образования CH3OH, что указывает на то, что дальнейшее дегидрирование частиц CH3O является неблагоприятным и затрудненным по сравнению с образованием CH3OH. Это может быть связано с тем, что геометрическая конфигурация частиц CH3O приводит к большому расстоянию между H в CH3O и O-соседним Rh. Это говорит о том, что виды CH3 при четырехкоординированном Rh стабильны и, таким образом, могут выступать в качестве предшественника для образования CH3OH.
Чтобы описать каталитическую природу Rh1O2/ZrO2, они проанализировали DOS Rh в Rh1O2 / ZrO2 и сравнили его с DOS в Rh1O4 / ZrO2. Результаты на рисунке 9 показывают, что в Rh1O2 / ZrO2 больше занятых состояний для Rh, чем в Rh1O4 / ZrO2, что указывает на то, что Rh в Rh1O2 / ZrO2 имеет более низкую степень окисления. Бэйдерский заряд Rh в Rh1O2 / ZrO2 был рассчитан как 7,6. Согласно связи между зарядом Бадера и степенью окисления Rh, Rh имеет степень окисления +3,6, ниже, чем степень окисления Rh в Rh1O4 / ZrO2 (+4,7), что согласуется с DOS результаты. Более низкая степень окисления Rh в Rh1O2 / ZrO2 указывает на то, что Rh1O2 / ZrO2 может более легко окисляться H2O2, способствуя адсорбции H2O2.
Перспективы нанокатализаторов при разработке попутного нефтяного газа
Для получения метанола основным является гетерогенный катализ. Особенностью гетерогенной катализа служит стадия адсорбции. Свойства каталитических активных участников зависят от свойств поверхности твердого тела. То есть при этом использование массивных материалов в отрасли экологии считается не выгодным. Так как в низ большая часть атома не находится на поверхности и не доступна реагирующим молекулам [45, 46].
Фактически выгоднее и эффективнее использовать катализаторы на основе наноразмерных частиц, что большая часть атомов катализатора представляется доступной реагентам. В результате чего эффективность катализа возрастет в десятки раз. При этом наночастицы многих веществ демонстрируют уникальные свойства, которые позволят использовать их в качестве нанокатализаторов.



