 Полная версия
Полная версияПолная версия:
Муковисцидоз: определение, диагностические критерии, терапия. Национальный консенсус
7. Griesenbach U., Alton E.W. Recent advances in understanding and managing cystic fibrosis transmembrane conductance regulator dysfunction. F1000 Prime Rep. 2015 May 27; 7: 64. (http://f1000.com/prime/ reports/m/7/64).
8. Marson F.A., Bertuzzo C.S., Ribeiro J.D. Classification of CFTR mutation classes Lancet Respir Med. 2016 Aug; 4 (8): e37-8.
9. De Boek K., Amaral M.D. Progress in therapies for cystic fibrosis lancet Respir Med. 2016 Aug; 4 (8): 662-74.
10. Borowitz D., Durie P.R., Clarke L.L., et al. Gastrointestinal outcomes and confounders in cystic fibrosis. J. Pediatr. Gastroenterol. Nutr. 2005 Sep; 41 (3): 273-285.
11. Ahmed N., Corey M., Forstner G. et al. Molecular consequences of cystic fibrosis transmembrane regulator (CFTR) gene mutations in the exocrine pancreas. Gut. 2003 Aug; 52 (8): 1159-1164.
12. Koch C., Cuppens H., Rainisio M., et al. European Epidemiologic Registry of Cystic Fibrosis (ERCF): comparison of major disease manifestations between patients with different classes of mutations. Pediatr Pulmonol. 2001 Jan; 31 (1): 1-12.
13. Koch C. Early Infection and Progression of Cystic Fibrosis Lung Disease. Pediatr Pulmonol. 2002 Sep; 34 (3): 232-236.
14. Smyth A.R., Bell S.C., Bojcin S. et al. European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. J. Cyst. Fibros. 2014 May; 13 Suppl. 1: S23-42.
15. http://www.cftr2.org
16. Richards S., Aziz N., Bale S., et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015. May; 17 (5): 405-424.
17. Wallis Y., Payne S., McAnulty C., et al. Practice Guideline for the Evaluation of Pathogenicity and the Reporting of Sequence Variants in Clinical Molecular Genetics. Available at https://www.acgs.uk.com
18. Clinical Genomics. A Guide to Clinical Next Generation Sequencing. Edited by S. Kulkarni, J. Pfeifer. Elsevier Inc., Academic Press, London, UK, 2015, p. 470. ISBN: 978-0-12-404748-8.
19. Quintáns B., Ordóñez-Ugalde A., Cacheiro P., et al. Carracedo, A., Sobrido, M.J. Medical genomics: The intricate path from genetic variant identification to clinical interpretation. Appl. Transl. Genom. 2014 Jun 16; 3 (3): 60-67.
20. Kerem E., Conway S., Elborn S., Heijerman H. Standards of care for patients with cystic fibrosis:a European consensus. J. Cyst. Fibros. 2005 Mar; 4 (1): 7-26.
21. Farrell P.M., Rosenstein B.J., White T.B., et al. Guidelines for diagnosis of cystic fibrosis in newborns through older adults: Cystic Fibrosis Foundation consensus report. J. Pediatr. 2008 Aug; 153 (2): S4-S14.
22. De Boeck K., Wilschanski M., Castellani C.J., et. al. Cystic fibrosis: terminology and diagnostical gorithms. Thorax. 2006 Jul; 61 (7): 627-635.
23. Bombieri C., Claustres M., De Boeck K .et al. Recommendations for the classification of diseases as CFTR-related disorders. J. Cyst. Fibros. 2011 Jun; 10 Suppl 2: S86-102.
24. Munck A., Mayell S.J., Winters V. Cystic Fibrosis Screen Positive, Inconclusive Diagnosis (CFSPID): A new designation and management recommendations for infants with an inconclusive diagnosis following newborn screening. J. Cyst. Fibros. 2015 Nov; 14 (6): 706-713.
25. Ooi C.Y., Castellani C., Keenan K. et al. Inconclusive diagnosis of cystic fibrosis after newborn screening. Pediatrics. 2015. Jun; 135 (6): e1377-85.
26. World Health Organization. Classification of cystic fibrosis and related disorders, Report of a Joint Working Group of WHO/ICF(M)A/ECFS/ECFTN, 2001. J. Cyst. Fibros. 2002 Mar; 1 (1): 5-8.
27. LaRusch J., Jung J., General I.J., et al. Mechanisms of CFTR functional variants that impair regulated bicarbonate permeation and increase risk for pancreatitis but not for cystic fibrosis. PLoS Genet. 2014. Jul. 17; 10 (7): e1004376.
28. Witt H. Chronic pancreatitis and cystic fibrosis. Gut. 2003 May; 52 Suppl. 2: ii31-41.
29. Pettit R.S., Fellner C. CFTR Modulators for the Treatment of Cystic Fibrosis. P T. 2014 Jul; 39 (7): 500-511.
30. Кондратьева Е.И. Инновационные методы терапии муковисцидоза. Врач. 2016, №2: 77-81.
31. Mall M., Grubb B.R., Harkema J.R., O’Neal W.K., Boucher R.C. Increased airway epithelial Na+ absorption produces cystic fibrosis-like lung disease in mice. Nat. Med. 2004 May; 10 (5): 487-493.
32. Sheridan M.B., Fong P., Groman J.D., et al. Mutations in the beta subunitof the epithelial Na+ channel in patients with a cystic fibrosis-like syndrome. Hum. Mol. Genet. 2005. Nov. 15; 14 (22): 3493-3498.
33. Gallati S. Disease-modifying genes and monogenic disorders: experience in cystic fibrosis. Appl. Clin. Genet. 2014. Jul. 10; 7: 133-146.
34. Красовский С.А., Каширская Н.Ю., Черняк А.В. и др. Генетическая характеристика больных муковисцидозом в Российской Федерации по данным Национального регистра (2014 г.). Пульмонология. 2016; 26 (2): 133-151.
35. Степанова А.А., Абрукова А.В., Саваскина Е.Н., Поляков А.В. Мутация p.E92K – основная причина муковисцидоза у чувашей. Генетика. 2012; 48 (7): 863-871.
36. Bobadilla J.L., Macek М., Jr., Fine J.P., Farrell P.M. Cystic fibrosis: a worldwide analysis of CFTR mutations – correlation with incidence data and application to screening. Hum. Mutat. 2002. Jun; 19 (6): 575-606.
37. Петрова Н.В., Тимковская Е.Е., Васильева Т.А. и др. Особенности спектра мутаций в гене CFTR у больных муковисцидозом из Карачаево-Черкесии. Медицинская генетика. 2015; 14 (7): 32-36.
38. Иващенко Т.Э., Баранов В.С. Биохимические и молекулярно-генетические основы патогенеза муковисцидоза. СПб.: Интермедика, 2002. 256 с. ISBN 5-89720-043-2.
39. Одинокова О.Н. Расширенный поиск мутаций гена CFTR в выборке больных муковисцидозом из Сибирского региона. Сборник тезисов VII Ежегодной Северо-Западной с международным участием научно-практической конференции по муковисцидозу «Практика лечения муковисцидоза» (Санкт-Петербург, 27-28 мая 2016). 2016. С. 9-13.
40. Castellani C., Benetazzo M.G., Tamanini A. et al. Analysis of entire coding region of the cystic fibrosis transmembrane conductance regulator gene in neonatal hypertrypsigenaemia with normal sweat test. J. Med. Genet. 2001. Mar; 38 (3): 202-205.
41. Петрова Н.В., Васильева Т.А., Тимковская Е.Е. и др. Анализ редких мутантных аллелей гена CFTR у российских больных. Сборник тезисов XI Национального конгресса «Муковисцидоз у детей и взрослых. Взгляд в будущее» (Москва, 24-25 мая 2013 г.). 2013. С. 66, 67.
42. Корытина Г.Ф., Викторова Т.В., Байкова Г.В., Хуснутдинова Э.К. Анализ спектра мутаций и полиморфных локусов гена трансмембранного регуляторного белка муковисцидоза в Башкортостане. Генетика. 2002; 38 (9): 1270-1275.
43. Рукавичкин Д.В. Клинико-генотипический полиморфизм муковисцидоза среди населения Краснодарского края: Дис. … канд. мед. наук: 03.00.15. Краснодар, 2007. 27 с.
44. Verlingue, N.I. Kapranov, B. Mercier et al. Complete screening of the coding sequence of the CFTR gene in a sample of CF patients from Russia: Identification of three novel mutations. Hum. Mutat. 1995; 5 (3): 205-209.
45. Одинокова О.Н. Молекулярная диагностика муковисцидоза в Сибирском регионе: поиск мутаций гена CFTR: Сборник статей и тезисов X Юбилейного Национального конгресса «Муковисцидоз у детей и взрослых». Ярославль, 2011. С. 60.
46. Степанова А.А., Красовский С.А., Поляков А.В. Информативность поиска 19 частых мутаций в гене CFTR у российских больных муковисцидозом и расчетная частота заболевания в Российской популяции. Генетика. 2015; 52 (2): 231-241.
47. Simakova T., Bragin A., Zaytseva M., et al. NGS-based assay for frequent newborn inherited diseases: from development to implementation. Doi: http://dx.doi.org/10.1101/050419
48. Павлов А.Е., Апалько С.В., Воробьев Е.В. Молекулярно-генетическая диагностика муковисцидоза в формате микрочипа. Лаборатория. 2012; (4):16-19.
49. Пренатальная диагностика наследственных и врожденных болезней. Под ред. акад. РАМН, проф. Э.К. Айламазяна, чл.-корр. РАМН, проф. ВС Баранова. 2-е изд. М.: МЕДпресс-информ, 2007. 416 С. ISBN 5-98322-345.
50. http://meduniver.com
51. Girardet A., Viart V., Plaza S., et al. The improvement of the best practice guidelines for preim plantation genetic diagnosis of cystic fibrosis: toward an international consensus. Eur. J. Hum. Genet. 2016. Apr. 24 (4): 469-478.
52. Harton G.L., De Rycke M., Fiorentino F. et al. ESHRE PGD consortium best practice guidelines for amplification-based PGD. Hum. Reprod. 2011. Jan; 26 (1): 33-40.
53. Claustres M., Kožich V., Dequeker E., et al. ESHG Quality committee. Recommendations for reporting results of diagnostic genetic testing (biochemical, cytogenetic and molecular genetic). Eur. J. Hum. Genet. 2014; Feb 22 (2): 160-170.
4. Микробиология и эпидемиология хронической респираторной инфекции при муковисцидозе
Хроническая инфекция нижних дыхательных путей (НДП) – ключевой признак у больных муковисцидозом (МВ). Она является ведущим фактором, определяющим тяжесть клинического течения и прогноз заболевания. При изучении микрофлоры НДП в различных возрастных группах детей, больных МВ, исследователями разных стран установлено, что основными возбудителями инфекции легких у больных МВ являются Р. aeruginosa, S. aureus и H. influenzae. Показано [1, 2], что в первые годы жизни у больных МВ доминирует золотистый стафилококк, а затем основным возбудителем становится синегнойная палочка. При анализе данных микробиологических исследований установлено, что условно-патогенные микроорганизмы выделяются у 61,9% детей в возрасте до 1 года, у 92,9% – в возрасте 1-4 лет, у 93,8% – в возрасте 5-7 лет и в возрасте 8-18 лет – у 100% детей. Это свидетельствует о том, что колонизация легких больных МВ микроорганизмами начинается фактически с первых дней после рождения и достигает максимума уже к 5 годам жизни. При этом если в группе детей до 1 года S. aureus выявляется только у 28,6%, а P. aeruginosa – у 19%, то в возрасте 5-7 лет золотистый стафилококк обнаружен у 87,5%, а P. aeruginosa – у 31,2%. Таким образом, в возрасте до 1 года более чем у 1/3 больных МВ НДП еще не обсеменены микроорганизмами, в возрасте 1-4 лет НДП обсеменены почти у всех больных (92,9%), а к 8-18 годам – у 100% больных. Хроническая стафилококковая, синегнойная или смешанная инфекция начинает диагностироваться у 25% детей уже в возрасте 1-4 лет, в возрасте 5-7 лет – у 50% больных, в возрасте 8-14 лет – у 65% и к 18 годам – у 80% больных МВ [3, 4].
В последнее десятилетие очевидную клиническую значимость приобретают недостаточно изученные микроорганизмы – неферментирующие грамотрицательные микроорганизмы (НФМО) – Вurkholderia cepacia complex (Bcc), Stenotrophomonas maltophilia, Achromobacter xylosoxidans, Achromobacter ruhlandii, нетуберкулезные микобактерии, грибы рода Aspergillus. При этом каждый патоген способен вызвать воспаление, которое может в той или иной степени привести к повреждению дыхательных путей, снижению легочной функции, ухудшению клинического статуса.
Согласно международным рекомендациям, о хронической инфекции, вызванной P. aeruginosa, может свидетельствовать идентификация патогена в течение двух и более раз за последние 6 месяцев. Аналогичными критериями можно руководствоваться при выявлении у больного в монокультуре S. aureus и Bcc, а также смешанной инфекции. С практической точки зрения приемлемыми являются и критерии, предложенные Lee et al. в 2003 г. [39], согласно которым обнаружение патогена более чем в 50% образцов мокроты или смывов в течение предшествующих 12 месяцев может трактоваться как хроническая инфекция.
Установлено, что в 2/3 случаев хроническая инфекция легких вызывается не монокультурой, а ассоциацией микроорганизмов, причем у госпитализированных больных, в отличие от амбулаторных больных, эти ассоциации представлены, как правило, не двумя, а тремя и более видами микроорганизмов. За рубежом [8, 9] эти показатели в 2 раза ниже: в 35% исследуемых образцов бронхоальвеолярного лаважа (БАЛ) выявляют рост двух микроорганизмов, и в 10% случаев ассоциации представлены тремя и более видами микроорганизмов. По данным российских авторов [3, 4], наиболее часто встречающейся ассоциацией является сочетание P. aeruginosa + S. aureus (18,2%), а также P. aeruginosa + Bcc (9,1%). В 18% случаев от больных в составе микробных ассоциаций выделяли одновременно P. aeruginosa мукоидного и немукоидного фенотипов. В составе ассоциаций кроме P. aeruginosa часто выделяли других представителей НФМО – [5, 6], что, вероятно, обусловлено тропизмом этих видов микроорганизмов к легочной ткани. Полученные данные послужили основанием для заключения, что у больных МВ характерным проявлением инфекционных осложнений является смешанная инфекция и что Bcc является типичным представителем госпитальной микрофлоры [3, 7].
Таким образом, при анализе микрофлоры больных МВ можно утверждать, что с увеличением возраста у больных формируются постоянные очаги хронической легочной инфекции, основными возбудителями которой являются P. aeruginosa и S. aureus.
Особенностью бактерий P. aeruginosa, S. aureus и Bcc, Achromobacter spp. является устойчивость ко многим антибиотикам.
4.1. Микробиологические свойства основных возбудителей хронической респираторной инфекции при муковисцидозе
Микроорганизмы, инфицирующие больного МВ, определяют лечение, качество жизни, перспективы для трансплантации и общую выживаемость. Точная и своевременная идентификация возбудителей инфекций дыхательных путей имеет существенное значение для обеспечения своевременного начала лечения соответствующими антибиотиками в целях элиминации бактериальных патогенов и организации надлежащего инфекционного контроля для профилактики распространения патогенных микроорганизмов среди больных МВ. Ниже приведены основные микробиологические характеристики доминирующих возбудителей хронической респираторной инфекции и представлен алгоритм ее микробиологической диагностики.
Staphylococcus aureus
В настоящее время род Staphylococcus, относящийся к семейству Micrococcus, включает 45 видов [8]. Вид S. aureus – золотистый стафилококк – является одним из значимых патогенов для пациентов с МВ. Он вызывает хроническую инфекцию легких, приобретаемую в обществе и во время лечения в госпитальных условиях [9].
Бактерии S. aureus представляют собой грамположительные неподвижные кокки, при микроскопии располагающиеся в виде характерных скоплений – гроздей. Стафилококки не образуют спор, но могут образовывать капсулы. У больных МВ могут выделяться 3 морфологических типа колоний – мукоидные, немукоидные и с SCV (small-colony varients)-фенотипом [9]. SCV-фенотип представляет собой мелкие, без гемолиза и пигмента, медленно растущие колонии на 5% кровяной и шоколадной плотных агаризованных средах.
Особое значение для больных МВ имеют метициллин-устойчивые стафилококки (MRSA), которые обладают устойчивостью ко многим антибиотикам. МRSA обнаруживаются во многих больницах большинства стран мира. MRSA распространяются от человека к человеку, обычно с рук медперсонала [23]. Однако могут встречаться и другие механизмы передачи, например воздушно-капельный. Некоторые штаммы являются чрезвычайно трансмиссибельными, распространяясь внутри палат, между палатами и из больницы в больницу [23].
Неферментирующие грамотрицательные микроорганизмы
Среди возбудителей хронической инфекции легких у больных МВ значимое место занимают НФМО, общими признаками которых являются природная устойчивость ко многим антибиотикам, высокая резистентность к дезинфектантам и распространение в больничных стационарах от больного к больному [10]. НФМО, наиболее часто вызывающие инфекции, принадлежат к нескольким родам и условно могут быть разделены на оксидазоположительные – роды Pseudomonas (кроме видов P. luteola и P. oryzihabitans), Burkholderia, Moraxella, Chryseobacterium – и оксидазоотрицательные – роды Stenotrophomonas, Acinetobacter, Bordetella (кроме B. pertussis, B. avium, B. bronchiseptica, B. hinzii) [11-13].
Большинство из упомянутых выше родов и видов НФМО обладают высокой степенью фенотипического и генотипического родства с бактериями рода Pseudomonas, и многие из них еще в 90-х гг. прошлого века относились к данному роду. Все эти микроорганизмы могут быть выделены из окружающей среды, однако клинической значимостью характеризуются только отдельные виды некоторых родов.
Pseudomonas aeruginosa
Первоначальная классификация рода Pseudomonas, состоящего из пяти соответствующих rRNA-групп, подверглась радикальному пересмотру, закончившемуся изменением классификации многих видов рода Pseudomonas и объединением в отдельные роды. Эти роды включают Burkholderia, Stenotrophomonas, Comamonas, Shewanella, Ralstonia, Methylobacterium, Sphingomonas, Acidovorax и Brevundimonas. Род Pseudomonas (sensu stricto) включает соответствующую rRNA-группу 1 и объединяет 11 видов: Pseudomonas aeruginosa, P. fluorescens, P. putida, P. veronii, P. monteilii, P. stutzeri, P. mendocina, P. pseudoalcaligenes, P. alcaligenes, P. luteola, P. oryzihabitans.
Псевдомонады являются аэробными неспорообразующими грамотрицательными палочками, которые могут быть прямыми или слегка изогнутыми. Они имеют от 1,5 до 5 мкм в длину и от 0,5 до 1,0 мкм в ширину и обладают строгим дыхательным метаболизмом с использованием кислорода как конечного акцептора электронов. Некоторые изоляты могут расти в анаэробных условиях с использованием нитратов или аргинина в качестве конечных акцепторов электронов. Псевдомонады подвижны благодаря присутствию одной или более полярных флагелл. Клинические изоляты являются оксидазоположительными (за исключением P. luteola, P. oryzihabitans) и каталазоположительными, а также растут на агаре МакКонки как лактозонегативные колонии [12].
Псевдомонады широко распространены в природе с преимущественным обитанием в окружающей среде, связанной с водой. Они обнаружены в воде, почве, на растениях, включая овощи и фрукты. Ввиду способности выживать в водной среде эти микроорганизмы, особенно P. aeruginosa, стали одной из основных проблем в качестве возбудителей госпитальных инфекций [12]. Бактерии P. aeruginosa являются ведущей причиной нозокомиальных инфекций дыхательного тракта. Особое значение имеют для больных МВ. Основную роль в патогенезе инфекции легких у больных МВ играют мукоидный фенотип P. aeruginosa и воспалительные реакции больного [1, 9, 14].
Бактерии Burkholderia cepacia complex (Bcc)
Бактерии Bcc – это группа грамотрицательных, неспоробразующих бактерий. В мазках, окрашенных по Граму, эти микроорганизмы представляют собой полиморфные прямые грамотрицательные палочки размером 0,5-1,0 х 1,5-5 мкм. После культивирования на 5% кровяном агаре при t = 30 °C в течение 48 ч бактерии Bcc образуют серые гладкие колонии с ровными краями размером 1-2 мм с резким характерным запахом гнили. При наличии пигмента колонии могут быть окрашены в желтый цвет различной интенсивности. Вокруг колоний могут образовываться зоны гемолиза. На средах Эндо и МакКонки колонии Bcc размером 1 мм окрашены в светло-розовый цвет (лактозонегативные).
В настоящее время вид B. cepacia sensu lato включает 20 близкородственных геномоваров.
Таблица 1. Представители Burkholderia cepacia complex
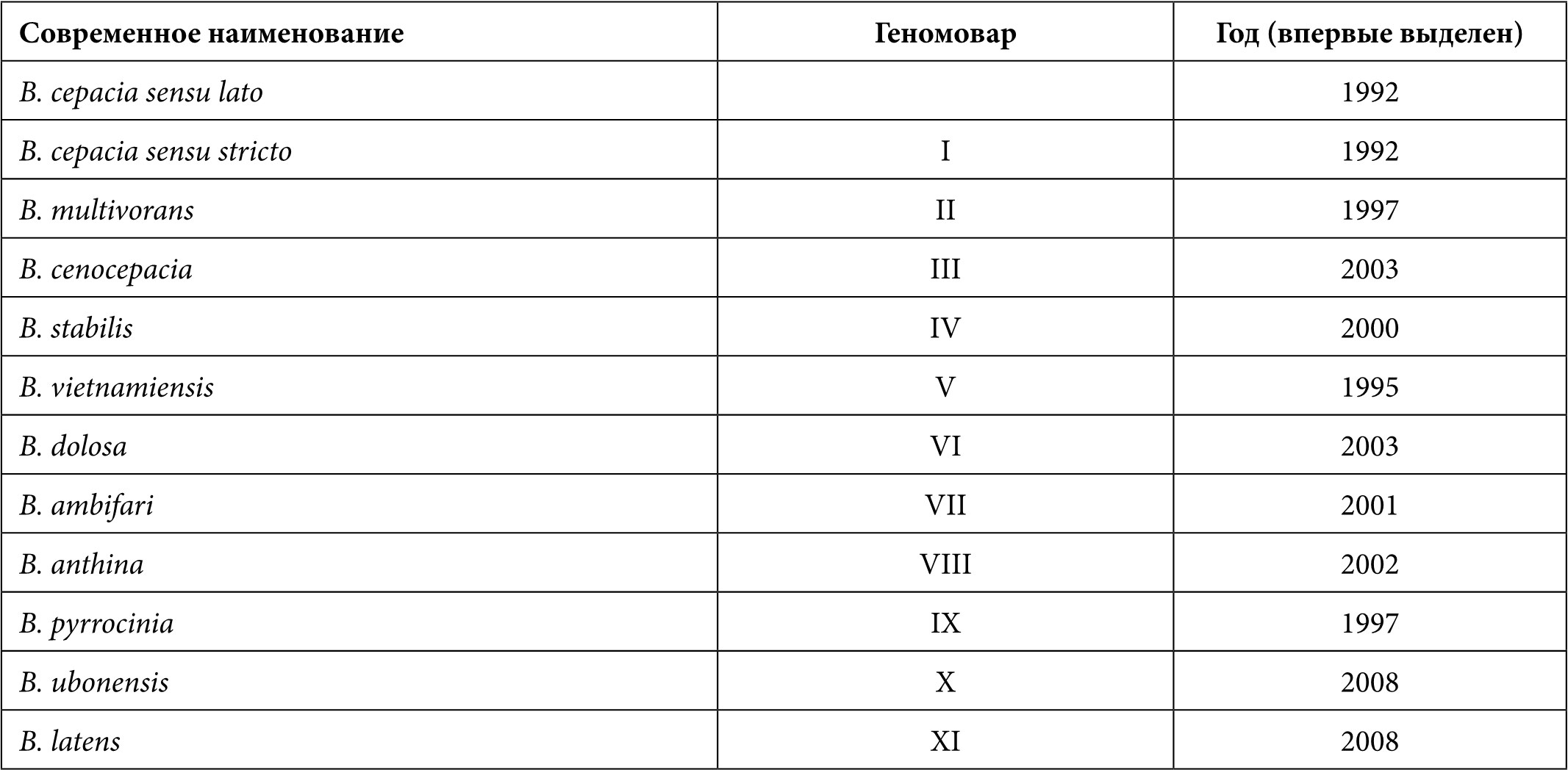
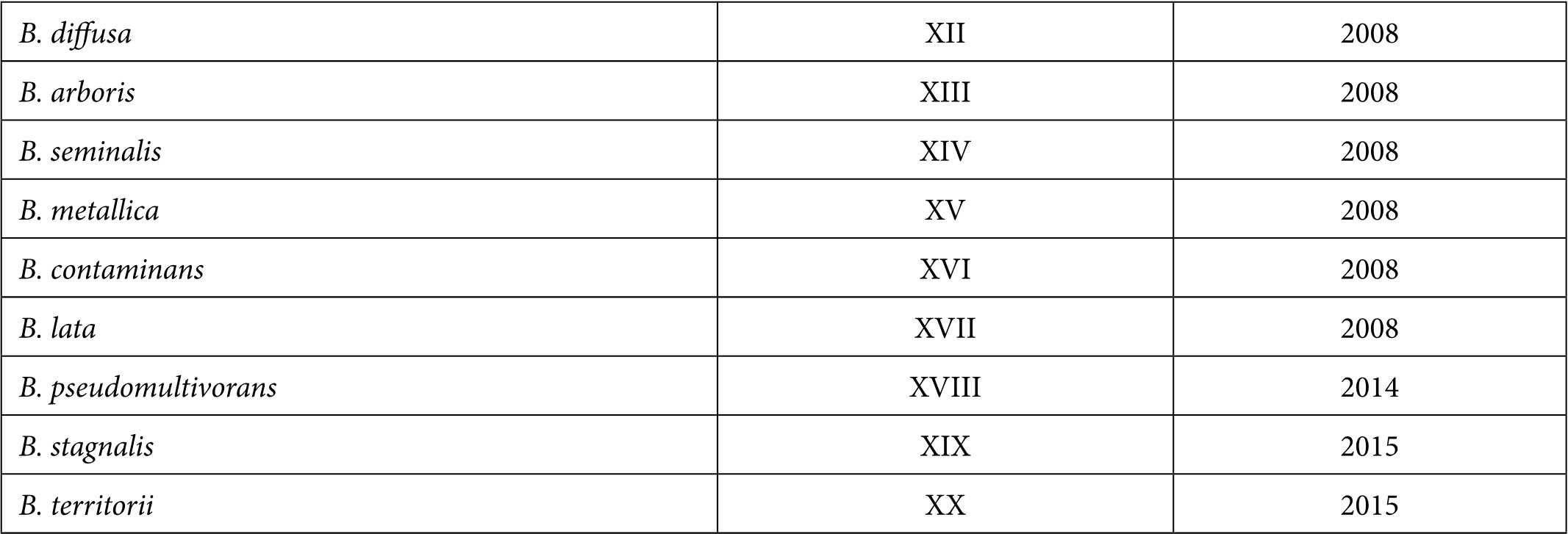
Все геномовары могут выделяться от больных МВ, однако преобладающим является геномовар III – B. cenocepacia, обнаруженный в 70% случаев инфекции, вызванной Bcc, в Англии, Бельгии, США, Канаде [15].
В России от больных МВ, а также при исследовании образцов от больных с пневмонией в отделениях интенсивной терапии различных клиник города Москвы также были выявлены бактерии Bcc, преимущественно принадлежащие к геномовару IIIA – B. cenocepacia [14, 16].
Клиническое значение бактерий Bcc и патогенез вызванной ими инфекции
О колонизации легких Bcc у больных МВ впервые сообщено в начале 1970-х гг. [38]. Приблизительно у 20% больных, колонизированных Bcc, возникал так называемый «сепация-синдром», характеризующийся некротизирующей пневмонией с лихорадкой, бактериемией, увеличением СОЭ и лейкоцитозом, который приводил к быстрому летальному исходу. Было высказано предположение, что появление Bcc является основной причиной неблагоприятного исхода у больных МВ. В настоящее время установлено, что Bcc представляет особую опасность для больных МВ. Хроническая микробная колонизация дыхательных путей ведет к развитию легочной инфекции – основной причины прогрессирования бронхолегочного процесса и смертности у больных МВ. Установлено, что особенностью инфекции при МВ является персистенция ассоциаций микроорганизмов в 59,4% случаев. Особенностью персистенции штаммов Bcc является тяжелое течение в виде смешанной инфекции в ассоциации с бактериями P. aeruginоsa. Бактерии Bcc, способные персистировать у больных МВ, характеризуются устойчивостью ко многим антибиотикам. Доказана длительная (до 1 года 5 мес) персистенция штаммов Bcc, выделенных от одного больного, с помощью мониторинга микрофлоры НДП. Штаммы Bcc, колонизируя НДП больных МВ, способны длительно персистировать и передаваться от пациента к пациенту [3, 17, 18].
Другие, более редко встречающиеся возбудители хронической респираторной инфекции –
Achromobacter xylosoxidans и Achromobacter ruhlandii
Род Achromobacter в настоящее время включает 15 видов и 7 генетических групп.
А. xylosoxidans, A. ruhlandii – оппортунистические патогены, оксидазо- и каталазоположительные грамотрицательные неферментирующие микроорганизмы. Обладают природной резистентностью ко многим антибиотикам.
В последнее время хроническая инфекция, вызванная Achromobacter xylosoxidans, Achromobacter ruhlandii, у больных МВ встречается часто. Согласно полученным данным, третьим по частоте встречаемости из НФМО является Achromobacter xylosoxidans. Он и Achromobacter ruhlandii при исследовании образцов от больных детей за 2012-2013 гг. выделялись в 9% случаев [14].
Род Acinetobacter
Номенклатура видов Acinetobacter находится в процессе развития. В настоящее время получили наименование 7 видов. Для рутинных клинических целей в номенклатуре достигнут компромисс, и организмы обозначаются как комплекс Acinetobacter calcoaceticus-baumannii. Большинство клинических лабораторий могут дифференцировать биовар anitratus от биовара lwofii на основе окисления глюкозы (anitratis) или неокисления последней (lwofii).
Подобно P. aeruginosa, бактерии рода Acinetobacter распространены в окружающей среде. У 25% здорового населения этим микроорганизмом колонизированы кожные покровы, а у 7% колонизирована глотка.
Виды Acinetobacter чаще всего вызывают внутрибольничную пневмонию. В больничном учреждении факторами риска для возникновения внутрибольничной пневмонии являются интубация, лечение антибиотиками, пребывание в палатах интенсивной терапии. Описан ряд инфекций, связанных с использованием медицинских приборов, например нозокомиальные менингиты. Чаще всего пневмонии как внутрибольничные инфекции возникали у больных раком и с травмами, а у ожоговых больных возникала раневая инфекция [10].
Stenotrophomonas maltophilia
Этот микроорганизм, ранее обозначавшийся как Pseudomonas maltophilia (до 1988 г.), позднее – Xanthomonas maltophilia (1995-1997 гг.), является распространенным комменсалом, легко выделяемым из воды, почвы и сточных вод. Значимость этого микроорганизма при выделении не всегда ясна и может зависеть от наличия факторов риска. Так, в одном исследовании, проведенном в общем госпитале в 1979 г., показано, что только 6 (4,6%) из 128 изолятов оказались клинически значимыми, то есть вызывали внутрибольничную инфекцию (ВБИ). С другой стороны, исследования в онкологическом центре показали, что ВБИ вызывали 114 (48%) из 237 изолятов. S. maltophilia наиболее часто связана с пневмонией, особенно у больных с МВ, но может также вызывать широкий круг других ВБИ. Наибольшее число инфекций встречается в больничных учреждениях, где факторы риска включают злокачественные опухоли, использование центральных венозных катетеров и лечение антибиотиками. В исследовании 91 случая бактериемий, вызванных S. maltophilia, у 78% больных были злокачественные опухоли, а источником инфекции был центральный венозный катетер. Показатель смертности от ВБИ в данном исследовании составил 38%.



