 Полная версия
Полная версияПолная версия:
Медицинские вопросы и проблемы подростков, больных муковисцидозом
Аномалии в биохимических анализах печени, такие как повышение аланинаминотрансферазы, аспартатаминотрансферазы или гаммаглутамилтрансферазы, являются распространенными. Тем не менее эти биохимические анализы слабо предсказывают тяжелое CLFD[217][218]. Действительно, до 25 % больных CF имеют аномальную биохимию печени при отсутствии явных гистологических данных гепатобилиарного фиброза. Кроме того, следует проводить развернутый анализ крови, коагулограмму и измерять уровни жирорастворимых витаминов. Тромбоцитопения вследствие гиперспленизма наблюдается при портальной гипертензии, и Международное нормализованное отношение (MHO) обеспечивает показатели оценки синтетической функции печени. Повышения MHO вероятнее могут быть следствием дефицита витамина К, чем дисфункции печени; рекомендуется дотация витамина К.
6.3. Ультразвуковое исследование (УЗИ) органов брюшной полостиУльтразвуковое сканирование органов брюшной полости с помощью метода Допплера для измерений портального венозного кровотока может быть полезным для обнаружения CFLD. В частности, обнаруженные узелковые уплотнения и спленомегалии представляют собой надежные маркеры тяжелого CFLD[219]. Тем не менее нормальные результаты УЗИ не исключают тяжелое CFLD. Повышенная эхогенность является неспецифическим признаком, общим для стеатоза и для фиброза. Кроме того, УЗИ обладает слабой предсказательной способностью для будущего развития CFLD[220].
6.4. Биопсия печениБиопсия печени остается золотым стандартом при диагностике установленного цирроза. Кроме того, сообщается, что фиброз печени на биопсии ретроспективно является единственной моделью, предсказывающей развитие тяжелого CFLD[221]. Тем не менее вследствие фокального и пятнистого распределения раннего CFLD тяжесть заболевания может быть недооценена при биопсии печени. Действительно, в недавнем исследовании было обнаружено, что фиброз печени мог быть пропущен в 22,5 % случаев при проведении однопроходной биопсии вероятнее, чем при двухпроходной биопсии[222]. Чтобы оценить ее важность в качестве маркера и судить о ее роли в клинической практике в свете сопутствующих рисков, необходимы перспективные исследования. Биопсия печени обычно требует общей анестезии и связана с редкими, но серьезными осложнениями, включающими кровотечение, билиарный перитонит и висцеральную перфорацию (приблизительно 2 %)[223].
6.5. Неинвазивные маркеры фиброза печениВ свете ограничений вышеописанных анализов большой интерес представляют альтернативные неинвазивные методы обнаружения фиброза. Для обнаружения фиброза печени при ряде хронических заболеваний печени предлагается транзиторная эластография, хотя она еще не оценена в исследованиях детей и больных CF и референтные пределы для детей отсутствуют.
6.6. Исключение других заболеваний печениПри наличии аномальной биохимии печени и/или других аномалий CFLD не следует ограничиваться изучением лежащей в основе заболевания причины. Следует учитывать другие состояния, поскольку они могут быть связаны со значительной заболеваемостью и смертностью, если остаются без лечения (таблица 5.1).
Таблица 5.1. Заболевания печени, отличающихся от обусловленных муковисцидозом заболеваний печени у подростков

7. Лечение тяжелого CFLD
7.1. Общие принципыВ настоящее время не существует специфической терапии для лечения или предупреждения тяжелого CFLD. Для лечения CFLD необходима многопрофильная бригада, состоящая из гастроэнтеролога, диетолога/ нутрициолога и хирурга, опытного в гепатобилиарной хирургии. Общие принципы лечения CFLD сходны с принципами лечения других хронических заболеваний печени. Независимо от наличия тяжелого CFLD важно последующее врачебное наблюдение, которое должно включать тщательное исследование брюшной полости при каждом посещении клиники и ежегодный скрининге использованием анализов крови и визуализации. Рекомендован ежегодный осмотр гастроэнтеролога (рис. 8). Последующее наблюдение у взрослого гастроэнтеролога после перехода на взрослую медицинскую помощь является обязательным, особенно у пациентов с установленным тяжелым CFLD.
8. Профилактическая терапия
8.1. Общие мерыПоскольку не существует специфической превентивной терапии для тяжелого CFLD, следует принимать общие меры для предупреждения не обусловленного CF повреждения печени: избегать гепатотоксических повреждений (например, лекарственных средств и алкоголя в подростковом возрасте) и вакцинации против вирусов гепатита А, гепатита В и ветряной оспы. Также важна идентификация других кофакторов (например, ожирения).
8.2. Лечение урсодеоксихолевой кислотойРоль урсодеоксихолевой кислоты (УДХК) при лечении и предупреждении тяжелого CFLD является спорной[224]. Лечение УДХК сопровождается улучшением биохимических показателей печени при CFLD[225][226][227]. Тем не менее биохимия печени является слабым маркером тяжести и прогрессирования заболевания печени, и прогрессирование может происходить при наличии нормальных биохимических маркеров печени[228][229][230][231][232]. Систематический обзор идентифицировал 10 плацебо-контролируемых испытаний, оценивающих УДХК в течение по меньшей мере 3 месяцев и включал три исследования для детальной оценки (n=118; возрастной диапазон 4-28 лет)[233]. Хотя были отмечены биохимические улучшения, клинически релевантные результаты портальной гипертензии, печеночной недостаточности, трансплантации печени или выживаемости не были сообщены ни в одном из этих исследований. В целом в этом обзоре сделан вывод, что данных в подтверждение положительных результатов применения УДХК при CFLD недостаточно.
Кроме данного систематического обзора, в одном исследовании описаны картины повторной биопсии печени при лечении УДХК[234]. В этом небольшом, свободном двухгодичном исследовании использование УДХК приводило в результате к биохимическим и гистологическим улучшениям у семи пациентов, прошедших повторную биопсию печени. Были улучшены как показатели воспалительных изменений, так и пролиферация желчных протоков. Клиническая значимость этих картин неясна в свете ограниченности исследования.
В большинстве исследований, в которых оценивали УДХК, рассмотрена ее роль при лечении установленного тяжелого CFLD. Потенциально более полезной задачей является предупреждение тяжелого CFLD. В одном итальянском исследовании оценивали превентивную роль УДХК при тяжелом CFLD[235]. Данное нерандомизированное перспективное исследование включало 26 детей с CF и мекониевой непроходимостью кишечника. В одной подгруппе (n=14) начинали лечение УДХК перед вторым днем рождения при отсутствии признаков CFLD (ранняя группа). Вторая подгруппа (n=12) получала УДХК, только когда были отмечены признаки CFLD на приеме у врача для последующего наблюдения. В течение 9-летнего периода наблюдения ни у одного ребенка из ранней группы не развилось CFLD. В противоположность этому, у 33 % (4/12) детей во второй группе развились признаки CFLD к концу периода обзора. Для подтверждения этих предварительных открытий необходимо обширное, перспективное и рандомизированное контролируемое исследование с применением более строгого определения тяжелого CFLD.
Кроме того, предшествующие рекомендации по применению УДХК основывались на отсутствии вреда и потенциальной пользе при CFLD вследствие описанных полезных свойств УДХК при других заболеваниях печени. Тем не менее положительная роль терапии УДХК при состояниях, для которых это лечение было рекомендовано ранее, таких как первичный склерозироующий холангит и первичный билиарный цирроз, недавно поставлена под сомнение[236][237]. Особое беспокойство вызывают результаты рандомизированного двойного слепого плацебо-контролируемого испытания высокой дозы УДХК (28–30 мг/кг/сутки) при первичном склерозирующем холангите[238]. Данное исследование было преждевременно прекращено в связи с повышенным риском смерти и трансплантации печени в группе лечения УДХК по сравнению с группой плацебо, несмотря на улучшение биохимических аномалий печени посредством УДХК. Кратко, в настоящее время не имеется данных, подтвердивших бы положительный эффект применения УДХК при лечении или предупреждении CFLD. Весьма необходимы исследования, проведенные надлежащим образом.
Для УДХК при CFLD существуют другие потенциальные роли. УДХК полезна для лечения зуда, хотя могут быть также полезны различные другие средства, включающие антигистаминные средства, холестирамин, рифампицин и налтрексон. Сообщается, что УДХК не является полезной для лечения холелитиаза при CF[239].
9. Диетотерапия
Оптимизация питания, ввиду его значительного влияния на рост и состояние легких, является ключевым аспектом лечения CF в целом. При тяжелом CFLD следует уделить особое внимание жирорастворимым витаминам и среднецепочечным триглицеридам. Ограничение употребления белка и натрия не является необходимым при компенсированном тяжелом CFLD.
10. Портальная гипертензия
В большинстве случаев заболеваемость и смертность от тяжелого CFLD связана с осложнениями, возникающими в результате портальной гипертензии. Варикоз вен пищевода и портальная гипертензивная гастропатия могут быть бессимптомными или проявляться угрожающим жизни желудочно-кишечным кровотечением. При наличии значительной спленомегалии рекомендуется избегать контактных видов спорта.
10.1. Эндоскопическое лигирование варикозно расширенных венВ настоящее время не существует четких конструктивных рекомендаций по предупреждению варикозного кровотечения при CF. Методы лечения включают использование β-блокаторов, эндоскопическое лигирование варикозно расширенных вен и операцию. Существуют также специальные соображения для пациентов с CF. Применение β-блокаторов является относительным противопоказанием при CF вследствие риска реактивности бронхов. Повторная общая анестезия для эндоскопии связана с риском легочных осложнений.
Оптимальное время для эндоскопического лигирования варикозно расширенных вен неясно – либо до, либо после первого кровотечения. Эндоскопическое исследование варикозных вен пищевода должно применяться при наличии клинических, гематологических (например, тромбоцитопении) или рентгенологических признаков портальной гипертензии. В недавнем исследовании количество тромбоцитов менее 115*109/л было связано с высокой отрицательной и положительной прогностической способностью для эндоскопической идентификации варикоза[240]. Поэтому целесообразно регулярное обследование (каждые 6-12 месяцев) при наличии варикоза вен пищевода.
10.2. Операция/шунтированиеПрименение трансяремного внутрипеченочного портосистемного шунта или портосистемных шунтов описано в малом исследовании серии случаев детей с тяжелым CFLD для лечения портальной гипертензии и/или в качестве перехода к трансплантации печени[241][242]. Частичная или полная спленэктомия может быть рассмотрена в качестве дополнительного метода лечения медицински нестабильной портальной гипертензии[243]. Эмболизация селезенки также описана в качестве альтернативы[244].
10.3. Трансплантация печениВ ситуации печеночной недостаточности, неустранимого варикозного кровотечения или портопульмонарного синдрома показана трансплантация печени[245]. Декомпенсированная печеночная недостаточность (асцит, желтуха, коагулопатия, неподдающаяся лечению витамином К, гепатопульмональный синдром или энцефалопатия) хоть и является редкой, но тем не менее дает плохой прогноз.
В обзоре Европейских педиатрических центров CF на основе анкетирования[246] основные показания для трансплантации в 57 случаях представляли собой печеночную недостаточность (69 %), гиперспленизм (57 %), плохое питание (47 %) и пищеводное кровотечение (27 %). Было отмечено, что в целом 89 % группы имело варикоз перед трансплантацией и 42 % страдало по меньшей мере одним кровотечением.
Недавно сообщены результаты Службы обеспечения донорскими органами (англ. United Network for Organ Sharing) для 148 детей с CFLD[247]. Эти были дети младше 14 лет (средний возраст 11,7 года), и почти две трети составляли мальчики. Большинство (п=143) этой группы перенесли трансплантацию печени, и только пять детей перенесли комбинированную трансплантацию легкого и печени. 5-летняя выживаемость для этих детей составляла 85,8 %. Хотя эта выживаемость была меньше, чем после трансплантации по другим показаниям, дети с CFLD после трансплантации получили значительное преимущество по сравнению с контрольной группой детей с CFLD, которые оставались в списке ожидания (то есть без трансплантации).
Кроме того, 5-летняя выживаемость для этой группы детей с CFLD была выше, чем в группе взрослых (72,7 %). Описана трансплантация печени в сочетании с другими органами, такими как печень – легкое, печень – сердце – легкое, печень – поджелудочная железа и печень – тонкая кишка, с перспективными данными выживаемости к настоящему времени[248][249].
Оптимальное время для трансплантации при CFLD остается неясным, но результаты длительного улучшения подтвердили ее право на использование. Для уточнения времени трансплантации была предложена балльная система, но этот метод имеет определенную системную ошибку в отношении варикозного кровотечения[250]. С учетом усовершенствований в эндоскопическом лечении варикозов и изменений в лечении методом трансплантации эта балльная система требует уточнения. Тем не менее стало ясно, что более ранняя трансплантация, когда она показана (печеночная недостаточность и/или неустранимая портальная гипертензия), приводит к лучшим результатам по сравнению с трансплантацией с задержкой[251]. Смертность также в значительной степени зависит от дыхательной функции[252] и питания. Тем не менее улучшение питания очевидно после трансплантации, если она удачна.
11. Дальнейшее исследование
Необходимо дополнительное исследование основ молекулярных механизмов. Остается определить сложные взаимодействия между модифицирующими генетическими факторами и факторами окружающей среды, влияющими на манифестации и тяжесть CFLD. Хотя не существует специфической терапии для лечения или предупреждения тяжелого CFLD, имеются вдохновляющие усовершенствования в способах лечения, нацеленных на улучшение CFTR[253].
12. Выводы
Диагноз тяжелого CFLD может быть поставлен в большинстве случаев до взрослого возраста. Отсутствие тяжелого CFLD к концу подросткового периода делает очень маловероятным, что у пациентов разовьются клинические значимые осложнения CFLD во взрослом возрасте. Важен регулярный скрининг и мониторинг.
Лечение тяжелого CFLD требует многопрофильного подхода с особым вниманием к профилактическим мерам, диетотерапии и лечению портальной гипертензии. Трансплантация печени у тщательно отобранных пациентов (печеночно-клеточная дисфункция и/или неустранимые осложнения портальной гипертензии) показывает удовлетворительные и все улучшающиеся результаты. Авторы надеются, что большее понимание патогенеза тяжелого CFLD приведет к эффективным превентивным и терапевтическим мерам.
БлагодарностиАвторы благодарят Dr Amanda Charlton, Children's Hospital at Westmead (Sydney, Australia) за предоставление гистопатологических изображений.
Глава 6
Соблюдение режима лечения подростками с муковисцидозом
Alexandra L. Quittner PhD, Adrianne N. Alpern MS, Laura S. Blackwell MA
Department of Psychology, University of Miami, Coral Gables, USA
Корреспонденция:
Alexandra L. Quittner, PhD Department of Psychology University of Miami Coral Gables USA
Tel: +1-305-284-6932
Fax: +1-305-284-4795
E-mail: aquittner@miami.edu
1. Введение
Лечение муковисцидоза нацелено на уменьшение симптомов заболевания, улучшение питания и роста и поддержание функции легких. В разработке медикаментозного лечения CF, включающего очищение дыхательных путей, ингаляционные антибиотики, пероральные лекарственные средства и употребление увеличенного количества калорий, совершен значительный прогресс. Недавно первое лекарственное средство, модифицирующее заболевание, VX770, было одобрено и стало доступно для небольшой подгруппы населения; его принимают один раз в сутки[254]. Несмотря на значительные достижения в диагностике и лечении CF, лечение этого заболевания продолжает требовать большого напряжения и изменения обычного порядка и занимает 2–4 часа в сутки в зависимости от тяжести заболевания[255]. Сложность данного режима делает его соблюдение особенно проблематичным.
Для детей младшего возраста родители, прежде всего, ответственны за организацию и помощь в лечении. У подростков, однако, имеется сдвиг в направлении большей независимости и автономии. Кроме того, что подростковый возраст является в целом беспокойным периодом, подростки с CF сталкиваются с дополнительными проблемами, связанными с ухудшением состояния здоровья, более частой госпитализацией и большей ответственностью за лечение своего заболевания. Это часто приводит к худшему соблюдению режима лечения[256][257]. В данной главе сделан обзор клинических аспектов соблюдения режима лечения для подростков с CF, включая показатели, прогностические факторы и последствия. Также обсуждаются подходы к измерению соблюдения режима лечения вместе с новыми стратегиями вмешательства для данной возрастной группы.
2. Показатели соблюдения режима лечения
Показатели соблюдения режима лечения зависят от степени вовлеченности пациента в процесс лечения[258]. Показатели соблюдения режима лечения для подростков с хроническими заболеваниями широко варьируют в зависимости от заболевания, сложности режима лечения и способа оценки[259][260]. Исследования соблюдения режима лечения при разных заболеваниях и в разных возрастных группах позволили предположить, что в среднем показатели составляют ниже 50 %[261][262]. Предшествующие исследования по заболеваниям продемонстрировали, что эти показатели выше для более простых методов лечения, включающих прием таблеток один раз в сутки, по сравнению с более сложными методами лечения, такими как модификация режима питания, очищение дыхательных путей, мониторинг глюкозы и использование ингаляторов[263][264].
Аналогичные показатели соблюдения режима лечения обнаружены при CF. В европейском исследовании взрослых с CF объективные данные, полученные на основании статистических данных повторной выписки рецептов и электронных мониторов, показали, что соблюдение режима лечения находилось в интервале от 67 % для пероральных антибиотиков до 31–53 % для ингаляционных антибиотиков, 53–79 % – для муколитических средств и 41–72 % – для гипертонического солевого раствора[265]. Сходные показатели соблюдения режима лечения (средний показатель 36 %) были обнаружены у взрослых в Великобритании при применении системы доставки l-Neb (Philips Respironics, Chichester, UK)[266]. Используя статистические данные повторной выписки рецептов, Eakin et al. сообщили о смешанном показателе соблюдения режима лечения, составляющем 62 % для ключевых пульмонологических лекарственных средств (то есть азитромицина, дорназы альфа, ингаляционного тобрамицина и гипертонического солевого раствора) у пациентов в возрасте от 6 лет до взрослого возраста[267]. McNamara et al. сообщили, что у детей с колонизацией Pseudomonas aeruginosa соблюдение ежемесячного применения ингаляционных антибиотиков находилось в интервале от 60 % до 70 % за 1 год[268].
В одном из немногочисленных исследований, изучающих соблюдение подростками множественных терапий, Modi et al. сообщили, что показатели соблюдения режима лечения находятся в интервале от 22 % до 71 % по объективным данным[269].
3. Прогностические факторы соблюдения режима лечения
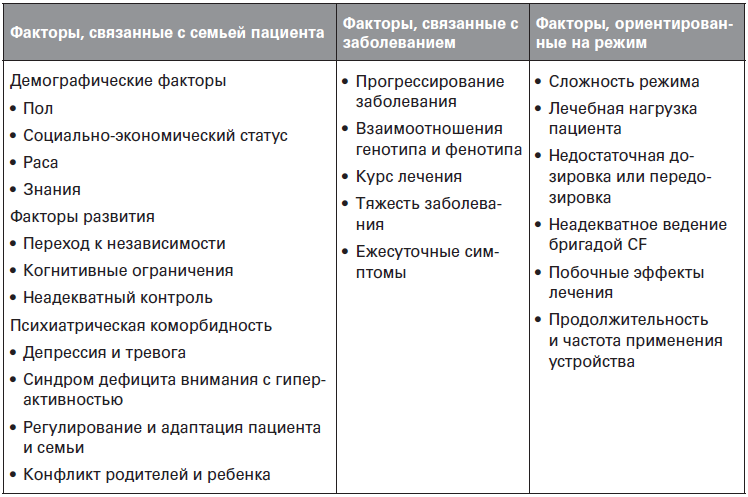
Причины плохого соблюдения режима лечения многогранны и включают факторы отношения к лечению пациента и семьи, изменения параметров заболевания и сложности режима лечения (таблица 6.1)[270][271]. Причины плохого соблюдения пациентом режима лечения включают взросление, более низкий социально-экономический статус, аспекты психического здоровья пациента и лица, осуществляющего уход, семейный конфликт и неприятие заболевания[272][273][274]. У детей, например, депрессивные симптомы связывали с неудовлетворительным выполнением правил очищения дыхательных путей[275]. Симптомы депрессии также распространены среди лиц, осуществляющих уход. Самый низкий показатель соблюдения режима лечения наблюдался при приеме панкреатических ферментов, приводящих в результате к невозможности прибавления веса к следующему посещению клиники[276]. Тревожное состояние также связано с соблюдением режима лечения: как высокий, так и низкий уровень тревоги оказывал отрицательное действие на следование режиму. Соответственно, пациенты, максимально соблюдающие режим лечения, проявляют средние уровни тревоги, в противоположность минимальной или сильной тревоге[277]. Напротив, существует несколько факторов, по-видимому, положительно влияющих на соблюдение режима лечения, например сплоченность в семье, социальная поддержка, чувство ответственности за чью-либо жизнь и эмпатия врача[278][279].
Таблица 6.1. Факторы, влияющие на соблюдение медицинских назначений подростками
4. Последствия плохого соблюдения режима лечения
Плохое соблюдение режима лечения чревато отрицательными последствиями как для пациентов, так и для системы здравоохранения в целом. Низкие показатели соблюдения режима лечения приводят к ухудшению состояния здоровья подростка, повышенной заболеваемости, более частой госпитализации и более ранней смерти[280]. Поскольку пациенты проводят больше времени в больнице, у них остается меньше времени на учебу в школе или встречи с друзьями и семьей, что напрямую снижает качество их жизни[281][282].
Последствия плохого соблюдения режима лечения не ограничиваются ухудшением здоровья подростка, но также включают необходимость более высоких затрат на лечение, принятия новых решений клинического уровня и усложняют интерпретацию клинических испытаний новых лекарственных средств[283][284]. Несколько исследований хронических патологических состояний показали, что плохое соблюдение режима лечения приводит к более высоким расходам системы здравоохранения и пустой трате ресурсов[285][286][287]. Недавние оценки позволяют предположить, что несоблюдение режима лечения обходится системе здравоохранения США приблизительно в $300 млрд ежегодно, включая $100 млрд на увеличение числа госпитализаций[288]. Для пациентов с CF Briesacher et al. обнаружили, что точное соблюдение режима лечения ингаляционным раствором тобрамицина привело к уменьшению числа легочных обострений и снижению риска госпитализации и, как следствие, – к снижению затрат системы здравоохранения[289]. Пациентам, на которых, на первый взгляд, не действуют назначенные методы лечения, но которые в действительности не соблюдают режим лечения, врачи могут повысить дозу или назначить новые лекарственные средства. Это увеличивает затраты на лекарственные средства и может привести к передозировке. Наконец, плохое соблюдение режима лечения может вызвать ошибку в клинических испытаниях в результате недооценки или переоценки эффективности лекарственного средства[290]. В большинстве клинических испытаний соблюдение пациентом режима лечения оценивают, используя косвенные методы, которыми можно легко пользоваться, такие как подсчеты флаконов и коробок. Альтернативные методы включают применение электронных мониторов, анализ уровня концентрации лекарственного средства или ежесуточные телефонные дневники пациента[291].
5. Измерение соблюдения режима лечения
Оценка соблюдения режима лечения крайне сложна с учетом числа возможных назначений при CF и различных способов их доставки (например, таблетки, небулайзеры, Acapella [Smith's Medical, St Paul, Minnesota, USA]). Способы оценки соблюдения режима лечения включают самоотчет, ежесуточные телефонные дневники, электронные мониторы и статистические данные повторной выписки рецептов, и каждый из них имеет сильные и слабые стороны.
Измерение на основе самоотчета включает непосредственный опрос пациентов, как они ведут себя в отношении соблюдения режима лечения. К сожалению, анализ самоотчетов постоянно дает завышенные оценки по сравнению с другими мерами, большей частью вследствие желания пациента казаться лучше и ошибок памяти[292]. Пациенты часто хотят «удовлетворить» своих врачей, а также имеют трудности с запоминанием того, как часто они совершают назначенные процедуры[293]. Хотя самоотчеты о соблюдении режима лечения менее точны, чем более объективные меры, такие анкеты, как Анкета соблюдения режима лечения (TAQ-CF; от англ. Treatment Adherence Questionnaire CF), являются полезными методами стимуляции самопроверки и диалога[294]. После их заполнения подростки комментируют, что они не понимали, как плохо они соблюдали режим лечения, до тех пор, пока не заполнили эту форму.



